Российский медицинский журнал артериальная гипертония
Представлено интервью с д.м.н., профессора Ф.Т. Агеевы, посвященное вопросам комплаентности, как фактора эффективного лечения артериальной гипертонии
Интервью с д.м.н., профессором Ф.Т. Агеевым, главным научным сотрудником отдела амбулаторных лечебно-диагностических технологий НИИ кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии» Минздрава России, Москва
Редактор «РМЖ»: Какова распространенность артериальной гипертонии на сегодняшний день и в чем опасность этого заболевания?
Ф.Т. Агеев: Сердечно-сосудистые заболевания (ССЗ) являются причиной около 900 тыс. смертей в России ежегодно, что составляет порядка 48% от всех причин смерти наших граждан. Артериальная гипертония (АГ) занимает лидирующие позиции среди заболеваний сердечно-сосудистой системы и в амбулаторной практике служит наиболее частой среди неинфекционных заболеваний причиной обращения к врачу [1, 2]. АГ — это величайшая в истории человечества неинфекционная пандемия, главная причина сердечно-сосудистых осложнений и смертности. В российской популяции распространенность АГ среди мужчин несколько выше, чем у женщин: в некоторых регионах она достигает 47%, тогда как среди женщин — около 40%. АГ является ведущим фактором риска развития ССЗ (инфаркт миокарда, инсульт, ишемическая болезнь сердца, хроническая сердечная недостаточность), цереброваскулярных (ишемический или геморрагический инсульт, транзиторная ишемическая атака) и почечных заболеваний (хроническая болезнь почек) [3, 4].
Редактор «РМЖ»: От чего зависит успех лечения гипертонической болезни?
Ф.Т. Агеев: Основная цель лечения больных АГ состоит в максимальном снижении риска развития осложнений. Для достижения этой цели необходимы снижение артериального давления (АД) до целевых уровней, коррекция всех модифицируемых факторов риска (курение, дислипидемия, гипергликемия, ожирение и др.), предупреждение/замедление темпа прогрессирования и/или уменьшение выраженности (регресс) поражения органов-мишеней, а также лечение имеющихся ССЗ, цереброваскулярных и почечных заболеваний. Для лечения АГ рекомендуется использовать пять основных классов антигипертензивных препаратов (АГП): ингибиторы ангиотензинпревращающего фермента (ИАПФ), антагонисты рецепторов ангиотензина II (блокаторы рецепторов ангиотензина II (БРА)), блокаторы кальциевых каналов (антагонисты кальция, АК), бета-адреноблокаторы (ББ) и диуретики [3, 5, 6]. Но эффективность лечения АГ зависит не только от правильной и своевременной постановки диагноза и выбора оптимальной стратегии и тактики лечения, но и от соблюдения больным предписанного режима терапии. Невысокий уровень приверженности лечению (комплаентности) при проведении гипотензивной терапии опасен тем, что при нерегулярном приеме препаратов возможно развитие неконтролируемой АГ. Отсутствие приверженности антигипертензивной терапии приводит к увеличению риска развития инфаркта миокарда и инсульта. Для повышения уровня комплаентности необходим целый комплекс мер, которые могли бы привести к более четкому соблюдению пациентом врачебных рекомендаций. Подобное повышение уровня комплаентности могло бы позволить снизить риск смерти от гипертонии и ее осложнений [7–11].
Редактор «РМЖ»: Как выбрать правильную медикаментозную терапию для пациента с гипертонией?
Ф.Т. Агеев:
Как указано в Российских рекомендациях по диагностике и лечению АГ, на выбор препарата оказывают влияние многие факторы, наиболее важными из которых являются: наличие у больного факторов риска; поражения органов-мишеней; ассоциированные клинические состояния, поражения почек, метаболический синдром, сахарный диабет; сопутствующие заболевания, при которых необходимо назначение или ограничение применения АГП различных классов; предыдущие индивидуальные реакции больного на препараты различных классов; вероятность взаимодействия с лекарствами, которые пациенту назначены по другим поводам; социально-экономические факторы, включая стоимость лечения. При выборе АГП необходимо в первую очередь оценить эффективность, вероятность развития побочных эффектов и преимущества лекарственного средства в определенной клинической ситуации [12]. Данные метаанализа 354 исследований по лечению АГ, в которых проводился суточный мониторинг АД (СМАД) (в него в общей сложности было включено почти 40 000 пациентов), продемонстрировали, что БРА (сартаны) в среднем обеспечивают наибольшее снижение среднесуточного систолического АД (САД) по сравнению с другими классами АГП по данным СМАД [13]. Настойчивость пациента и приверженность назначенной антигипертензивной терапии являются ключевыми компонентами управления гипертензией. Из всех АГП при применении БРА отмечается наибольшая приверженность лечению как в течение 1 года, так и 4 лет. Эти препараты обладают наиболее благоприятным профилем безопасности и наименьшим количеством побочных эффектов [14–16].
Редактор «РМЖ»: Чем определяется эффективность БРА (сартанов) в лечении пациентов с ССЗ?
Ф.Т. Агеев: Избыточная активация ренин-ангиотензин-альдостероновой системы (РААС) приводит к развитию множества патологических процессов и играет важную роль на всем протяжении так называемого сердечно-сосудистого континуума. В начале этого континуума повышение активности РААС приводит к развитию АГ, затем — к поражению органов-мишеней АГ (сосуды, сердце, головной мозг, почки). Все это ведет к развитию осложнений со стороны сердечно-сосудистой системы, таких как инфаркт миокарда и инсульт. У пациентов, перенесших инфаркт, повышенная активность РААС вызывает ремоделирование миокарда и в конечном итоге
развитие дисфункции левого желудочка, хронической сердечной недостаточности. Итогом всех этих процессов становится смерть от ССЗ. Антагонисты рецепторов ангиотензина позволяют блокировать негативные эффекты избыточной активации РААС на всех этапах сердечно-сосудистого континуума [14–18].
Редактор «РМЖ»: Какие препараты способны снижать эффекты гиперактивации РААС?
Ф.Т. Агеев: В настоящее время для коррекции активности РААС используют следующие группы препаратов: ИАПФ, БРА (сартаны), ББ, диуретики и прямые ингибиторы ренина. Впервые синтезированные в 1971 г. блокаторы рецепторов ангиотензина II (БРА) сегодня — это один из современных и наиболее динамично развивающихся классов. В основе механизма их действия — подавление активности ангиотензина II. БРА селективно предотвращают стимуляцию рецепторов AT1, с которыми связано большинство отрицательных эффектов ангиотензина II. В повседневной клинической практике используются такие сартаны, как лозартан, валсартан, кандесартан, телмисартан, азилсартан и некоторые другие. При этом степень сродства к рецепторам ангиотензина II 1 типа у препаратов данной группы различна и в порядке убывания выглядит так: азилсартан > олмесартан > кандесартан > эпросартан > валсартан > лозартан [14–18].
Редактор «РМЖ»: Какими фармакологическими характеристиками обладает блокатор рецепторов ангиотензина II кандесартан?
Ф.Т. Агеев: Кандесартан — селективный антагонист рецепторов ангиотензина II 1 типа. В результате блокирования AT1-рецепторов ангиотензина II происходят дозозависимое повышение активности ренина, концентрации ангиотензина I, ангиотензина II и снижение концентрации альдостерона в плазме крови. Cmax в плазме крови достигается в течение 3–4 ч. Концентрация в плазме возрастает линейно при увеличении дозы в терапевтическом интервале (до 32 мг). Объем распределения (Vd) — 0,13 л/кг. Связывание с белками плазмы — 99,8%. Незначительно метаболизируется в печени (20–30%) при участии CYP2C с образованием неактивного метаболита. Конечный T1/2 — 9 ч. Не кумулирует. Общий клиренс — 0,37 мл/мин/кг, при этом почечный клиренс — около 0,19 мл/мин/кг. Кандесартан выводится почками (путем клубочковой фильтрации и активной канальцевой секреции): 26% — в виде кандесартана и 7% — в виде неактивного метаболита; с желчью — 56% и 10% соответственно. После однократного приема в течение 72 ч выводится более 90% дозы. Степень сродства к рецепторам ангиотензина II 1 типа, а также данные, что кандесартан имеет больше участков связывания AT1-рецепторов с молекулами ангиотензина II по сравнению с лозартаном и валсартаном, определяют гипотензивную и органопротективную активность кандесартана [14–17, 19–23].
Редактор «РМЖ»: Какова эффективность кандесартана у пациентов с АГ? Проводились ли сравнительные исследования эффективности и безопасности кандесартана с другими гипотензивными препаратами?
Ф.Т. Агеев: Эффективность, безопасность и хорошая переносимость кандесартана у пациентов с АГ были показаны в нескольких крупных международных исследованиях.
Сравнение первых четырех появившихся в клинической практике БРА, а также отношения между дозой и антигипертензивным эффектом лозартана, валсартана, ирбесартана и кандесартана представлены в обзоре D. Elmfeldt et al. [24], где оценивались данные, полученные из отчетов по оценке FDA соответствующей информации о новых лекарственных препаратах. Были проанализированы все доступные на тот момент рандомизированные двойные слепые плацебо-контролируемые параллельные групповые исследования для взрослых мужчин и женщин с первичной гипертензией от легкой до умеренной. Отобранные исследования были включены в метаанализ зависимости доза/эффект для каждого препарата по показателю изменения диастолического артериального давления (ДАД). Данный метаанализ показал, что кандесартан способен снижать ДАД значительно больше, чем валсартан, лозартан и ирбесартан в рекомендуемых дозах. Следовательно, различия в эффективности между различными блокаторами АТ1-рецепторов действительно существуют, и это должно учитываться при выборе БРА при лечении больных гипертонией с целью наилучшего контроля за АД [24].
Интерес вызывает оригинальное по дизайну исследование TROPHY [25]: первый и единственный на данный момент научный опыт применения антигипертензивных средств у больных с так называемой предгипертонией. Предгипертония (высокое нормальное АД по классификации Российского кардиологического общества / Российского медицинского общества по артериальной гипертонии) считается предшественником гипертонии 1-й стадии и предиктором чрезмерного сердечно-сосудистого риска. Основной вопрос, на который ответили исследователи: возможно ли при своевременной рациональной гипотензивной фармакотерапии предгипертонии предотвратить гипертонию или временно отложить развитие гипертензии 1 стадии. В исследование были включены участники с повторными измерениями САД от 130 до 139 мм рт. ст. и ДАД 89 мм рт. ст. или ниже, которым назначался на 2 года кандесартан или плацебо на фоне немедикаментозного лечения, а затем на 2 года плацебо для всех групп. В общей сложности 409 участников получали случайным образом терапию кандесартаном. В течение первых 2 лет гипертоническая болезнь развилась у 154 участников из группы плацебо-контроля и у 53 из группы получавших кандесартан (относительное снижение риска — 66,3%, р<0,001). Через 4 года гипертония развилась у 240 участников группы плацебо-контроля и у 208 из группы кандесартана (относительное снижение риска — 15,6%; р<0,007). Серьезные побочные эффекты отмечались у 3,5% участников, получавших кандесартан, и 5,9% пациентов, получавших плацебо. Таким образом, было показано, что в течение 4 лет у большинства участников с высоким нормальным АД (предгипертония) развивалась АГ, несмотря на немедикаментозные мероприятия, однако добавление в терапию на этапе предгипертонии кандесартана было не только безопасно и хорошо переносилось, но и снижало риск развития АГ. Эффект сохранялся даже после отмены препарата, хотя, естественно, ослабевал [25].
В двойном слепом исследовании Y. Lacourcie`re и R. Asmar (1999) [26] с участием более 250 пациентов сравнивался антигипертензивный эффект терапии кандесартаном 8 или 16 мг/сут и лозартаном 50 мг/сут при длительном приеме, включая пропуск дозы. Была отмечена лучшая гипотензивная эффективность кандесартана в дозе 8 и 16 мг по показателям САД и ДАД, также был отмечен лучший контроль САД и ДАД при пропуске дозы у пациентов, получающих терапию кандесартаном. Было отмечено, что кандесартан характеризуется наиболее прочным связыванием с рецепторами к ангиотензину II подтипа I и наименьшей скоростью диссоциации от этих рецепторов [26].
Сравнение кандесартана и лозартана также представлено в исследовании S.E. Kjeldsen et al. (2010) [27]. Было проанализировано 24 943 истории болезни пациентов с диагнозом АГ в 72 центрах Швеции по конечным точкам «госпитализация» и «смерть по любым причинам». Пациенты амбулаторно получали лозартан (n=6771) или кандесартан (n=7329). В группах не было различия по показателю АД у принимающих лозартан и кандесартан. По сравнению с группой лозартана группа кандесартана имела более низкую частоту госпитализаций с диагнозом ССЗ (0,86, доверительный интервал 95% (ДИ) 0,77–0,96, р=0,0062), сердечной недостаточности (0,64, 95% ДИ 0,50–0,82, р=0,0004), сердечных аритмий (0,80, 95% ДИ 0,65–0,92, р=0,00330) и заболеваний периферических артерий (0,61, 95% ДИ 0,41–0,91, р=0,0140). Таким образом, при сходной гипотензивной эффективности кандесартан оказывал лучшее прогностическое влияние на риск госпитализации по причине обострения ССЗ [27].
В исследовании CLAIM [28] (8-недельное многоцентровое двойное слепое рандомизированное исследование) в параллельных группах оценивалась антигипертензивная эффективность кандесартана в сравнении с лозартаном у 654 пациентов с гипертонической болезнью и ДАД от 95 до 114 мм рт. ст. в 72 центрах США. Пациенты были рандомизированы в группы кандесартана 16 мг 1 р./сут или лозартана 50 мг 1 р./сут. Через 2 нед. после рандомизации пациенты удвоили соответствующие дозы блокаторов ангиотензина на 6 нед. На 8-й нед. отмечалось более значительное снижение САД и ДАД в группе кандесартана в сравнении с группой лозартана (13,3/10,9 мм рт. ст. кандесартан vs 9,8 / 8,7 мм рт. ст. лозартан; p<0,001). В то же время в группе кандесартана отмечались более значительное снижение максимальных значений АД, а также больший процент лиц, отвечающих на терапию, и пациентов, достигающих контрольных целевых значений АД (62,4% и 56,0% соответственно), чем в группе лозартана (54,0% и 46,9% соответственно). Оба режима лечения хорошо переносились. По причине развития нежелательных реакций от терапии отказались 1,8% пациентов в группе кандесартана и 1,6% в группе лозартана. Таким образом, при назначении максимальной разовой дозы кандесартан показывал лучшую эффективность в сравнении с лозартаном при хорошей переносимости обоих препаратов [28].
В исследовании ALPINE назначение кандесартана больным с АГ в сравнении с терапией ББ атенололом было метаболически нейтральным и достоверно реже приводило к возникновению метаболического синдрома и сахарного диабета [29]. В многоцентровом проспективном рандомизированном открытом исследовании HIJ-CREATE с участием 2049 пациентов в 14 центрах по всей Японии с острым коронарным синдромом (35,3%) и первичным инфарктом миокарда (38,0%) слепым методом оценивали конечные точки, включавшие коронарную реваскуляризацию и впервые возникший сахарный диабет. В группе кандесартана частота развития впервые возникшего сахарного диабета была ниже на 63% (p=0,027) по сравнению с частотой в группе, получающей стандартную терапию [30].
Редактор «РМЖ»: Оказывает ли кандесартан нефропротективный эффект?
Ф.Т. Агеев: В рандомизированном двойном слепом исследовании SMART приняли участие 269 пациентов с протеинурией. Пациенты после 7 нед. терапии кандесартаном 16 мг/сут были рандомизированы на 3 группы, получавшие 16, 64 или 128 мг/сут кандесартана в течение 30 нед. Результаты показали, что средняя разница протеинурии была -16% у пациентов, получавших 64 мг/сут кандесартана, и -33% у лиц, получавших 128 мг/сут кандесартана, по сравнению с пациентами, получавшими кандесартан в дозе 16 мг/сут. Снижение АД не отличалось во всех трех группах лечения. Результаты исследования показали дозозависимость антипротеинурического эффекта кандесартана, достигающую максимума при применении его в дозе, превышающей рекомендуемую максимальную, но тем не менее оказывающуюся сравнительно безопасной [32].
Необходимо отметить также, что эффективность БРА в снижении микроальбуминурии не зависит от полиморфизма ренин-ангиотензинового гена. Как и для ИАПФ, БРА свойственно внутригрупповое разнообразие, в первую очередь связанное с липофильностью/водорастворимостью и степенью выведения препарата почками. По мере прогрессирования хронической болезни почек доза сартанов с почечным выведением (кандесартан) и двойным выведением (ирбесартан, валсартан) уменьшается. Только доза телмисартана, на 98% выводящегося печенью, и эпросартана (75%) не корригируется в зависимости от стадии хронической болезни почек [20, 32].
Редактор «РМЖ»: Можно ли назвать Гипосарт препаратом выбора для лечения пациентов с АГ?
Ф.Т. Агеев: Эффективность и безопасность воспроизведенного препарата Гипосарт (кандесартан) представляются совокупностью гемодинамических, нейрогуморальных и метаболических эффектов, обеспечивающих положительный прогноз и достоверную органопротекцию у пациентов с АГ и хронической сердечной недостаточностью.
Соединяя в себе хорошую переносимость, простоту использования и отсутствие выраженных побочных эффектов, Гипосарт может считаться препаратом первого выбора для лечения пациентов с АГ и хронической сердечной недостаточностью, а выгодная цена делает появление этого препарата социально и экономически значимым событием на отечественном фармацевтическом рынке.
Источник
Артериальная гипертензия (АГ) в женской популяции характеризуется рядом гендерных особенностей, что играет немаловажную роль в развитии ишемической болезни сердца (ИБС).
По данным исследований NHANES II, ГНИЦПМ, частота АГ у женщин с возрастом стремительно растет: в 55–64 лет она составляет 46,5–53%, а в группе старше 65 лет — 68% [1].
Nanchanal et al. в исследовании, включавшем 14 тыс. здоровых женщин, показали, что риск развития ИБС в течение последующих 10 лет их жизни тесно связан с уровнем АД. Риск для женщин с высоким нормальным АД был в 4 раза больше, чем для женщин с нормальным АД. У женщин с АГ, даже получавших удовлетворительную гипотензивную терапию, риск ИБС был в 8 раз выше. Для женщин с неадекватной терапией риск был выше почти в 19 раз [2].
Помимо показателей АД (по данным исследования NHANES III, после 59 лет у женщин отмечается максимальная частота АГ) у женщин, по сравнению с мужчинами, выше частота сердечных сокращений (ЧСС) в покое, сердечный индекс, ниже общее периферическое сопротивление сосудов, наблюдается высокая вариабельность АД, чаще выявляется «гипертония белого халата».
Важная особенность АГ у женщин — тенденция к нарастанию пульсового давления как суррогатного маркера жесткости артериальной стенки, в связи с тем что после 50 лет уровень систолического АД (САД) у них продолжается увеличиваться, в то время как уровень диастолического АД (ДАД) удерживается на прежних значениях или даже снижается [3].
Считается, что причинами, приводящими к этим изменениям у женщин, являются меньшая протяженность артериального русла, большая ЧСС, более короткая диастола и низкий ударный объем [4]. Повышение уровня пульсового давления считается мощным независимым предвестником последующих коронарных событий [5].
Гипертрофия левого желудочка (ГЛЖ) у женщин встречается чаще, чем у мужчин, причем преобладает концентрическая ГЛЖ (утолщение стенок левого желудочка (ЛЖ) без изменения размеров полости). У мужчин же чаще встречается эксцентрическая ГЛЖ [6].
Исследование WHJ, в котором принимали участие 98 705 женщин в возрасте 50–79 лет, выявило АГ у 38% пациенток. Доказана достоверная прямая зависимость между частотой встречаемости АГ и возрастом — у женщин 70–80 лет АГ встречалась в 2 раза чаще, чем в возрасте 50–60 лет [7].
Основными факторами риска (ФР) развития АГ являлись вес тела (частота встречаемости АГ составила 48% против 29% соответственно с ИМТ>27,3% и ИМТ<27,3%); наличие/отсутствие физической активности (соответственно 45% против 31%); потребление алкоголя (соответственно 46% и 36% у злоупотребляющих алкоголем). Часто формирующееся абдоминальное ожирение, зачастую сочетающееся с нарушениями углеводного и липидного обмена, влечет за собой развитие инсулинорезистентности, которая приводит к снижению синтеза оксида азота (NO), повышению содержания свободных жирных кислот, угнетению активности NO-синтетазы. Все это способствует повышению чувствительности эндотелиальной стенки к констрикторным действиям различных веществ, в свою очередь повышая частоту развития АГ [8, 9].
Период постменопаузы характеризуется перестройкой эндокринной системы и дефицитом синтеза эстрогенов, оказывающих влияние на резистентность периферических сосудов, синтез нейромедиаторов, вазоактивных пептидов, простациклина и тромбоксана.
Важную роль в патогенезе АГ у женщин в постменопаузе играет как снижение уровня женских половых гормонов, так и увеличение уровня андрогенов в крови. Повышение уровня тестостерона вызывает увеличение активности симпатоадреналовой (САС) и ренин-ангиотензин-альдостероновой систем (РААС). Тестостерон оказывает прямое действие на канальцы почек, способствуя задержке натрия в организме. Кроме того, тестостерон увеличивает уровень эндотелина в крови и усиливает оксидативный стресс.
Ожирение является независимым ФР коронарных заболеваний, застойной сердечной недостаточности (ЗСН), инсультов; большинство из них является исходами плохо контролируемой АГ. У женщин с ожирением сердечно-сосудистый риск увеличивается в 4 раза.
По данным исследования АРГУС, в России среди женщин старше 55 лет нормальную массу тела (ИМТ<25 кг/м2) имели 24% пациенток с впервые выявленной изолированной систолической АГ (ИСАГ) и 40% — с систолодиастолической АГ. Кроме того, в развитии АГ у женщин (кроме менопаузы!) имеют значение гиперхолестеринемия, отсутствие физической активности и психологические факторы.
У большинства женщин, принимающих пероральные контрацептивы, наблюдается небольшое, но достоверное повышение АД. Следует отметить, что в настоящее время пероральные контрацептивы содержат более низкие дозы эстрадиола (20–35 мг), но все равно необходимо проводить регулярное измерение АД каждые 6 мес.
По данным исследования TOMHS [10], у женщин зарегистрировано в 2 раза больше нежелательных явлений, чем у мужчин.
Следует сделать ряд заключений по АГ у женщин:
- у мужчин наблюдается тенденция к более высоким цифрам АД по сравнению с женщинами репродуктивного возраста, после наступления менопаузы или проведения овариоэктомии различия между мужчинами и женщинами исчезают;
- у женщин до 60 лет распространенность АГ ниже, после 60 лет — выше, чем у мужчин;
- ИСАГ чаще встречается в возрасте старше 60 лет, преимущественно у женщин с избыточной массой тела;
- в репродуктивном периоде риск сердечно-сосудистых осложнений у женщин в 3 раза ниже, чем у мужчин;
- АГ не является абсолютным противопоказанием к назначению заместительной гормональной терапии (ЗГТ);
- современные препараты для ЗГТ не оказывают существенного влияния на уровень АД у женщин с/без АГ в менопаузе;
- наличие отягощенной наследственности и заболеваний почек в анамнезе является относительным противопоказанием для назначения пероральных противозачаточных средств;
- у женщин чаще наблюдается ГЛЖ при ИСАГ, а также инсульт и ЗСН на фоне АГ;
- женщины более осведомлены о наличии у них АГ, чаще получают антигипертензивные препараты, у них в отличие от мужчин выше вероятность достижения целевого АД;
- антигипертензивная терапия оказывает одинаковое влияние на уровень АД у мужчин и женщин. Однако у женщин наблюдается менее выраженное снижение общего сердечно-сосудистого риска на фоне адекватного контроля АД.
Ретроспективный анализ 5 рандомизированных клинических исследований, включавших 12 тыс. пожилых больных, преимущественно женщин (возраст старше 60 лет), показал, что активное снижение АД сопровождалось снижением сердечно-сосудистой смертности на 23%, количества случаев ИБС — на 19%, случаев сердечной недостаточности (СН) — на 48%, частоты инсультов — на 34%.
Целесообразны снижение и поддержание АД на уровне ≤140/90 мм рт. ст., а при сопутствующих сахарном диабете (СД) и почечной недостаточности АД следует снижать до <135/85 мм рт. ст.
Начинать терапию нужно с устранения модифицируемых ФР, таких как избыточный вес, курение, чрезмерное употребление соли.
Различия в фармакокинетике лекарств у мужчин и женщин могут быть обусловлены более низкой массой тела у женщин, меньшим размером органов, более высоким содержанием жировой ткани по сравнению с мужчинами. Различия в уровне гормонов у мужчин и женщин могут влиять на всасывание и элиминацию лекарств. Менопауза может стать причиной изменения фармакокинетики лекарственных средств вследствие не только изменений концентрации эстрадиола, но и увеличения объема жидкости в организме. Доказано, что эстрогены и прогестины вступают во взаимодействие со многими лекарствами, применяемыми при сердечно-сосудистых заболеваниях. Половые различия существуют и в элиминации лекарственных средств, поскольку скорость клубочковой фильтрации у женщин ниже, чем у мужчин, даже после поправки на площадь поверхности тела. У женщин существует также более высокий риск некоторых специфических нежелательных реакций.
При лечении АГ у женщин постменопаузального периода следует отдавать предпочтение антигипертензивным препаратам, которые не оказывают отрицательного метаболического действия и/или способствуют нормализации метаболических нарушений. К таким препаратам относят: ингибиторы ангиотензинпревращающего фермента (иАПФ), антагонисты рецепторов ангиотензина (АРА) II, антагонисты кальция (АК) и высокоселективные β-адреноблокаторы (БАБ).
Для устранения рефлекторной тахикардии, повышающей потребность миокарда в кислороде, показано добавление кардиоселективных БАБ и АК длительного действия (верапамил, дилтиазем).
Селективный b-блокатор метопролол преимущественно метаболизируется CYP2D6 [11]. У мужчин выше активность этого фермента и характерен более быстрый его клиренс. Вследствие этого у женщин достоверно выше плазменный уровень метопролола [12, 13]. Его действие усиливается при приеме оральных контрацептивов [13–15]. Плазменная концентрация пропранолола у женщин на 80% выше, чем у мужчин [15]. Более высокий уровень БАБ в плазме у женщин соотносится с более выраженным снижением ЧСС и АД у женщин, чем у мужчин, под их влиянием [12].
Известны гендерспецифические особенности для некоторых блокаторов кальциевых каналов [16–18]. Эти лекарственные вещества подвергаются первичному метаболизму при прохождении через печень и являются субстратами для CYP3А4, активность которого у женщин выше, чем у мужчин [19–21]. Соответственно, у женщин более высокий клиренс и ниже сывороточная концентрация блокаторов кальциевых каналов, например нифедипина, чем у мужчин [18]. У женщин также выше клиренс верапамила при в/в введении. Клиренс верапамила у женщин с возрастом замедляется. Это объясняет, почему у пожилых женщин (старше 60 лет) снижение АД под его влиянием более эффективно, чем у молодых (от 20 до 30 лет) [22]. В исследовании АССТ установлено, что при терапии амлодипином снижение АД более выраженное у женщин, чем у мужчин [23].
Активность ангиотензинпревращающего фермента — точки приложения иАПФ — у женщин в пременопаузе ниже, чем в постменопаузе [24].
При сопутствующей дисфункции ЛЖ и СН препаратами выбора являются иАПФ, АРА.
Механизмы действия иАПФ при хронической сердечной недостаточности (ХСН):
- ослабление нейрогуморальных вазоконстрикторного и антидиуретического звеньев, усиление вазодилатирующего компонента патогенеза ХСН;
- расширение периферических сосудов, снижение преднагрузки и постнагрузки на сердце;
- уменьшение дилатации камер сердца, регресс гипертрофии миокарда (замедление процесса ремоделирования сердца);
- увеличение сократительной способности миокарда и сердечного выброса;
- улучшение диастолического наполнения желудочков;
- диуретическое и нефропротективное действие;
- снижение клубочковой гипертензии;
- предотвращение электролитного дисбаланса и опосредованного антиаритмического эффекта;
- улучшение функции эндотелия и антиишемического эффекта.
При назначении иАПФ:
- следует избегать одновременного назначения препаратов, дополнительно снижающих АД (АК, БАБ, нитратов);
- отменить нестероидные противовоспалительные препараты;
- прекратить прием диуретиков;
- отменить психотропные препараты (хлорпромазин, тиоридазин и др.);
- ступенчатое титрование дозы (каждые 5–7 дней).
Дозировки иАПФ представлены в таблице 1.

Для купирования гипертонического криза используют гипотензивные препараты короткого и среднего действия — иАПФ, АРА, БАБ с внутренней симпатомиметической активностью, препараты центрального действия (клонидин, празозин и др.). При гипертонических кризах, протекающих с явлениями СН, препаратами выбора являются нитраты. Следует избегать быстрого и чрезмерного снижения АД (<100/70 мм рт. ст.), т. к. это может спровоцировать тахикардию, усиление ишемии миокарда.
M. Hudson et al. изучали в течение 5 лет результаты лечения ЗСН, в т. ч. сочетание АГ и ХСН, с использованием АРА и иАПФ у мужчин и женщин. В исследовании приняли участие 10 223 женщины (8627 принимали иАПФ, 1956 — АРА) и 9475 мужчин (8484 принимали иАПФ, 991 — АРА). Было отмечено, что 3-месячная выживаемость значительно выше в группе женщин, принимавших АРА, чем в группе принимавших иАПФ, а также выше, чем у мужчин обеих групп [26].
Механизм действия АРА:
- подавление активности РААС на уровне клеточных рецепторов;
- ослабление эффектов ангиотензина (АТ) II;
- не подавляется активность киназы II, разрушающей брадикинин (отсутствие побочных явлений — бронхоспазма, кашля);
- подавление активности только РААС;
- широкий спектр действия, высокая селективность (обязательный контроль уровней АД, калия, креатинина).

Дозировки АРА приведены в таблице 2. Сравнение эффектов иАПФ и АРА отображено в таблице 3.
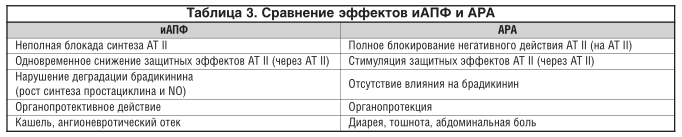
Нам видится, что большая эффективность АРА наблюдается в женской популяции с АГ. АРА II целесообразно применять при плохой переносимости иАПФ [27, 28]. Представители класса АРА могут различаться между собой степенью сродства к АТ1-рецепторам за счет имеющихся различий в модели взаимодействия с рецепторами.
Сравнивалась антигипертензивная активность олмесартана медоксомила с другими сартанами — лозартаном, валсартаном и ирбесартаном [29]. Через 8 нед. лечения снижение уровней САД и ДАД при терапии олмесартана медоксомилом было достоверно больше, чем при приеме лозартана, валсартана и ирбесартана.
В исследовании S. Nakayama et al. сравнивалось влияние олмесартана медоксомила в дозе 20 мг с телмисартаном в дозе 40 мг на повышенные уровни АД у пациентов с СД 2-го типа [30]. Через 8 нед. при терапии олмесартаном было отмечено достоверно большее снижение «офисных» уровней АД и по данным суточного мониторирования АД.
В двойном слепом рандомизированном исследовании MARAVEL, в котором сравнивали прием ирбесартана в дозе 150–300 мг/сут и эналаприла 10–20 мг/сут, оба препарата снижали АД до целевых значений (128,8 и 79,9 мм рт. ст. в группе ирбесартана и 127,2 и 80,5 мм рт. ст. — в группе эналаприла). Однако частота, вероятно, связанных с лечением побочных эффектов составила всего 9,2% в группе ирбесартана в сравнении с 24,6% в группе эналаприла [31].
Немаловажен нефропротективный эффект БРА при диабетической нефропатии и микроальбуминурии, протеинурии (класс I, уровень доказательности В). Например, в исследовании IDNT у пациентов с АГ и диабетической нефропатией риск удвоения креатинина на 37% ниже в группе ирбесартана (р<0,001) в сравнении с группой, принимающей амлодипин. Кроме того, относительный риск развития терминальной стадии почечной недостаточности был на 23% ниже в группе ирбесартана [32].
Важное место в лечении, наряду с иАПФ и АРА, также занимают агонисты J1-имидазолиновых рецепторов, обладающие положительным гипотензивным эффектом и повышающие чувствительность тканей к инсулину; они вызывают эффекты торможения гиперактивности САС, приводящие к снижению АД и уменьшению ЧСС, способствуют снижению уровня холестерина липопротеинов низкой плотности, толерантности к глюкозе.
Женщины в постменопаузе являются более солечувствительными, чем мужчины. У большинства женщин в постменопаузе имеется объем-зависимый тип АГ с наличием сопутствующих метаболических нарушений. В таких случаях эффективен тиазидоподобный диуретик индапамид. Он способствует снижению АД, воздействует на сосудистый тонус и водно-электролитный баланс, обладает кардиопротективными свойствами, не нарушает углеводный и липидный обмен.
Биодоступность ацетилсалициловой кислоты (АСК) у женщин выше, чем у мужчин благодаря более медленному клиренсу и достоверно более длительному периоду полувыведения [33]. Благоприятные эффекты приема АСК или клопидогрела для женщин и мужчин доказаны при вторичной профилактике кардиоваскулярных заболеваний.
Важных различий в плазменной концентрации клопидогрела и его активных метаболитов у женщин не обнаружено. По данным исследований (CURE, CREDO, CLARITY-TIMI 28), гендерных особенностей в протективном эффекте клопидогрела не выявлено, но частота кровотечений у женщин выше [34].
Несмотря на возросший интерес к проблеме женского здоровья, остается много нерешенных вопросов, что связано с недостаточным числом клинических исследований и наблюдений, необходимых для разработки алгоритмов диагностики сердечно-сосудистых заболеваний у женщин, понимания гендерной фармакологии и стратификации риска кардиоваскулярных событий в женской популяции.
Таким образом, выявленные особенности патогенеза и клинического течения АГ у женщин должны обязательно отражаться на принципах фармакотерапии с целью снижения риска кардиоваскулярных событий. Раннее назначение комбинированной антигипертензивной терапии, использование АРА, обладающих эндотелийпротективным и нефропротективным действием, способствует предупреждению прогрессирования АГ и уменьшению сердечно-сосудистых осложнений в женской популяции.
Источник


