Растворимость газов в воде при повышенном давлении
Влияние давления
на растворимость твердых и жидких
веществ практически не сказывается,
т.к. объем системы при этом изменяется
незначительно. Только при очень высоких
давлениях изменение растворимости
становится заметным. Так, например,
растворимость NH4NO3снижается почти вдвое при повышении
давления до 106кПа (т.е. приблизительно
в 10 000 раз больше атмосферного).
Существенное
влияние давление оказывает лишь на
растворимость газов. Причем если между
газом и растворителем не возникает
химического взаимодействия, то согласно
закона Генри растворимость газа
при постоянной температуре прямо
пропорциональна его давлению над
раствором
S=kp
где
k – коэффициент
пропорциональности, зависящий от природы
жидкости и газа; p
– давление газа над раствором.
Закон Генри
справедлив только для разбавленных
растворов и в условиях низких давлений.
Если речь идет
о растворении не одного газообразного
вещества, а смеси, состоящей из нескольких
газов, то согласно закона Дальтона
растворимость каждого компонента смеси
при постоянной температуре пропорциональна
его парциальному давлению над жидкостью
и не зависит от общего давления смеси
и присутствия других газов.
Парциальное
давление отдельного газа в смеси (р1)
рассчитывается по формуле:
р1= робщ.· Х1
где
робщ. – общее давление
газовой смеси; Х1 – мольная
доля газа в смеси.
Если газовая смесь
состоит из нескольких компонентов, то
ее общее давление определяется суммой
парциальных давлений всех газов, входящих
в смесь:
робщ.= р1+ р2+ р3+ …
Газы, вступающие
во взаимодействие с растворителем
(например, NH3,
SO2,
HCl) при
растворении в Н2О
закону Генри и Дальтона не подчиняются.
Их растворимость также увеличивается
с повышением давления, но по более
сложной зависимости.
Понижение давления
газа над раствором ведет к уменьшению
его растворимости и выделению из жидкости
в виде пузырьков.
Изменением
растворимости газа при резком снижении
давления обусловлена так называемая
кессонная болезнь, которой могут заболеть
водолазы, работающие глубоко под водой.
В этих условиях они дышат воздухом,
находящимся под большим давлением. При
этом растворимость газов в крови сильно
увеличивается. Если после окончания
работы подниматься на поверхность
слишком быстро, то вследствие резкого
уменьшения давления избыточные газы,
растворенные в крови, начинают бурно
выделяться. Образовавшиеся пузырьки
закупоривают кровеносные сосуды, что
приводит к нарушению кровообращения,
многочисленным кровоизлияниям в
различных тканях и органах из-за разрыва
капилляров.
Поэтому подъем на
поверхность с больших глубин должен
быть достаточно долгим и медленным,
чтобы лишний газ успевал удаляться из
кровеносной системы через органы
дыхания.
Аналогичная картина
может возникнуть и при разгерметизации
на большой высоте кабин и салонов
самолетов, скафандров военных летчиков.
Влияние температуры на растворимость веществ
Растворимость
большинства твердых и жидких веществ
при повышении температуры в той или
иной степени увеличивается. Для некоторых
твердых веществ (особенно если при их
растворении теплота выделяется)
растворимость, наоборот, может понижаться
с повышением температуры.
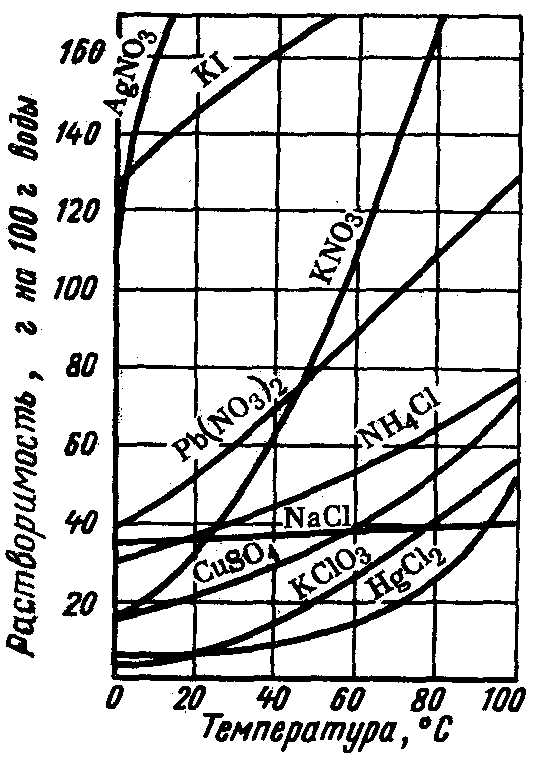
Зависимость
растворимости веществ от температуры
часто наглядно показывают при помощи
графиков, которые называют кривыми
растворимости (рис. 20).
Растворимость
газов уменьшается с повышением
температуры. Длительным кипячением
можно почти полностью удалить растворенные
газы из жидкости. Насыщение же жидкости
газом, наоборот, целесообразнее проводить
при низких температурах.
Изменением
растворимости с температурой часто
пользуются для очистки веществ путем
перекристаллизации. При остывании
горячего насыщенного раствора какой-либо
соли, загрязненной посторонними
примесями, значительная ее часть (соли)
выделится в виде осадка, а загрязняющие
примеси останутся в растворе, так как
последний даже на холоде по отношению
к ним не будет насыщенным.

2
Рис. 20.Кривые растворимости твердых веществ
(1) и газов (2) в зависимости от температуры
Подобным образом
можно очищать лишь те твердые вещества,
растворимость которых сильно зависит
от температуры.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Все газы растворяются в жидкостях, причем процесс растворения всегда оказывается экзотермическим. Это легко понять: молекулы газа ни с чем не связаны, затрата энергии на разрыв каких-либо химических связей отсутствует. Из этого следует, что растворимость газов уменьшается при повышении температуры. Если оставить в теплом помещении стакан с холодной водой, то на внутренней поверхности стакана через некоторое время появляются пузырьки газа — это воздух, который был растворен в воде, выделяется из нее вследствие нагревания. Кипячением можно удалить из воды весь содержащийся в ней воздух или другие газы.
Газообразное вещество отличается от жидкого и твердого еще и тем, что не имеет постоянной концентрации в собственной фазе. При изменении давления изменяется содержание газа в единице объема. Это влияет на равновесие между жидкостью и газом, и таким образом, растворимость газа зависит от давления. О том, какова взаимосвязь между давлением и растворимостью газа, можно сделать вывод самостоятельно, зная, что при откупоривании бутылки с газированным напитком наблюдается бурное выделение пузырьков газа.
Представим себе замкнутый сосуд, в котором установилось равновесие между газообразным веществом и его раствором в жидкости:
газообразное вещество X вещество X в растворе.
При увеличении давления газа за счет добавления его в сосуд равновесие сместится так, что давление несколько понизится — часть газа перейдет в раствор, и концентрация вещества в растворе увеличится. Следовательно, увеличится растворимость. Зависимость растворимости газа от давления подчиняется закону Генри.
Растворимость газа в жидкости пропорциональна давлению газа над поверхностью жидкости.
В природных водах всегда присутствует растворенный воздух, иначе говоря, все газы, имеющиеся в воздухе, растворяются и в воде. Па растворимость отдельно взятого газа не влияет давление, создаваемое другими газами. Например, парциальное давление кислорода в воздухе составляет 21 кПа. Остальные 80,3 кПа приходятся на давление азота и других газов и влияют на их растворимость, но не на растворимость кислорода. Закон растворимости газов был уточнен Дальтоном и носит название закона Генри — Дальтона.
Растворимость газа X в жидкости пропорциональна парциальному давлению данного газа над поверхностью жидкости:

Коэффициент растворимости к зависит от температуры; каждый газ имеет свое значение к.
Зависимость растворимости газа от его парциального давления используется для насыщения жидкости тем или иным газом. Струю газа пропускают (барботируют) через жидкость. Газ растворяется в соответствии с созданным давлением, и одновременно удаляются все другие растворенные газы.
В одном литре воды при О °С и давлении углекислого газа 101,3 кПа растворяется 3,35 г этого газа. Можно увеличить давление газа вдвое, тогда и растворимость газа увеличится вдвое — до 6,7 г/л. При удвоенном давлении эта масса в виде газа занимает тот же объем, что и 3,35 г при первоначальном давлении, так как масса газа в данном объеме при данной температуре пропорциональна давлению:

Таким образом, оказывается, что объемная растворимость газа не зависит от давления. Она зависит от температуры и природы газа. Поэтому растворимость газа наиболее удобно выражать через объемный коэффициент растворимости Ку. Численно он равен объему газа, растворяющемуся в единице объема жидкости при данной температуре. В табл. 12.1 приведены объемные коэффициенты растворимости некоторых газов в воде. Газы с Kv 1 считаются малорастворимыми (02, Н2, N2, СН4, благородные газы); умеренно растворимые газы (С02, H2S, С12) имеют Kv, не сильно превышающий 1; у хорошо растворимых газов (NH3, S02) Kv> 1.
Таблица 12.1
Объемные коэффициенты растворимости газов в воде
Газ | К у= Угаз / Увода | |
0°С | 20 °С | |
Водород | 0,0215 | 0,0184 |
Кислород | 0,0489 | 0,031 |
Азот | 0,02354 | 0,01545 |
Гелий | 0,0097 | 0,0086 |
Аргон | 0,0524 | 0,0335 |
Метан | 0,005563 | 0,0331 |
Угарный газ | 0,0354 | 0,0232 |
Углекислый газ | 1,713 | 0,878 |
Оксид азота(П) | 0,0738 | 0,0471 |
Хлор | 4,61 | 2,3 |
Оксид ссры(1У) | 79,79 | 39,37 |
Аммиак | 986 | 702 |
Пример 12.11. В замкнутый сосуд объемом 2 л помещены 1 л воды и углекислый газ под давлением 101,3 кПа при 0 °С. Каким станет давление С02 после насыщения воды этим газом?
Решение. В таблице 12.1 находим объемный коэффициент растворимости С02: Kv= 1,713. В данной системе растворение такого объема газа эквивалентно расширению газа до конечного объема 1 л + 1,713 л = 2, 713 л. Давление газа уменьшится в соответствии с законом Бойля — Мариотта:

Источник
Влияние природы веществ на растворимость
Установлено опытным путем, что в растворителе, молекулы которого полярны, лучше всего растворяются вещества, образованные ионными или ковалентными полярными связями. А в растворителе, молекулы которого неполярны, лучше растворяются вещества, образованные слабополярными или неполярными ковалентными связями. По другому эту выявленную закономерность можно сформулировать так: «Подобное растворяется в подобном».
Растворимость веществ во многом обуславливается силой и характером их взаимодействия с молекулами растворителя. Чем сильнее выражено это взаимодействие, тем больше растворимость и наоборот.
Известно, что силы, действующие между неполярными и слабополярными молекулами, невелики и неспецифичны, т.е. в количественном выражении существенно не зависят от вида вещества.
Если в неполярную жидкость В ввести однотипные неполярные молекулы А, то энергия взаимодействия частиц А и В между собой не будет значительно отличаться от энергии взаимодействия между частицами А и А или частицами В и В. Поэтому подобно тому как смешиваются любые количества одного и того же вещества, с большой вероятностью будут неограниченно смешиваться друг с другом (т.е. растворяться друг в друге) и различные неполярные жидкости.
По этой же причине и молекулярные кристаллы обычно лучше растворяются в неполярных жидкостях.
Если же энергия взаимодействия молекул А и А или В и В больше чем А и В, то одинаковые молекулы каждого компонента будут предпочтительнее связываться между собой и растворимость их друг в друге понизится (табл. 6).
Полярность любого растворителя часто характеризуют значением его диэлектрической проницаемости (ε), которая легко определяется опытным путем. Чем она больше, тем более полярным является вещество.
Таблица 6. Растворимость KI (мас%) в растворителях различной полярности
| Растворитель | Н2О | CH3OH | н-С4Н9ОН | C6H6 |
| Диэлектрическая проницаемость растворителя, ε | 80,4 | 31,2 | 10,72 | 2,3 |
| Растворимость, KI | 59,8 | 14,97 | 0,2 | 0,00016 |
Растворимость веществ значительно повышается если они способны образовывать с растворителем водородные или донорно-акцепторные связи. Примером большой растворимости, обусловленной образованием водородных связей, является раствор этилового спирта в Н2О, а образованием донорно-акцепторных связей – раствор NH3 в воде. При этом растворимость спирта не ограничена, а NH3 в Н2О растворяется в объемном соотношении ~ 700 : 1.
Влияние давления на растворимость твердых и жидких веществ практически не сказывается, т.к. объем системы при этом изменяется незначительно. Только при очень высоких давлениях изменение растворимости становится заметным. Так, например, растворимость NH4NO3 снижается почти вдвое при повышении давления до 106 кПа (т.е. приблизительно в 10 000 раз больше атмосферного).
Существенное влияние давление оказывает лишь на растворимость газов. Причем если между газом и растворителем не возникает химического взаимодействия, то согласно закона Генри растворимость газа при постоянной температуре прямо пропорциональна его давлению над раствором
S = kp
где k – коэффициент пропорциональности, зависящий от природы жидкости и газа; p – давление газа над раствором.
Закон Генри справедлив только для разбавленных растворов и в условиях низких давлений.
Если речь идет о растворении не одного газообразного вещества, а смеси, состоящей из нескольких газов, то согласно закона Дальтона растворимость каждого компонента смеси при постоянной температуре пропорциональна его парциальному давлению над жидкостью и не зависит от общего давления смеси и присутствия других газов.
Парциальное давление отдельного газа в смеси (р1) рассчитывается по формуле:
р1 = робщ. · Х1
где робщ. – общее давление газовой смеси; Х1 – мольная доля газа в смеси.
Если газовая смесь состоит из нескольких компонентов, то ее общее давление определяется суммой парциальных давлений всех газов, входящих в смесь:
робщ. = р1 + р2 + р3 + …
Газы, вступающие во взаимодействие с растворителем (например, NH3, SO2, HCl) при растворении в Н2О закону Генри и Дальтона не подчиняются. Их растворимость также увеличивается с повышением давления, но по более сложной зависимости.
Понижение давления газа над раствором ведет к уменьшению его растворимости и выделению из жидкости в виде пузырьков.
Изменением растворимости газа при резком снижении давления обусловлена так называемая кессонная болезнь, которой могут заболеть водолазы, работающие глубоко под водой. В этих условиях они дышат воздухом, находящимся под большим давлением. При этом растворимость газов в крови сильно увеличивается. Если после окончания работы подниматься на поверхность слишком быстро, то вследствие резкого уменьшения давления избыточные газы, растворенные в крови, начинают бурно выделяться. Образовавшиеся пузырьки закупоривают кровеносные сосуды, что приводит к нарушению кровообращения, многочисленным кровоизлияниям в различных тканях и органах из-за разрыва капилляров.
Поэтому подъем на поверхность с больших глубин должен быть достаточно долгим и медленным, чтобы лишний газ успевал удаляться из кровеносной системы через органы дыхания.
Аналогичная картина может возникнуть и при разгерметизации на большой высоте кабин и салонов самолетов, скафандров военных летчиков.
Дата добавления: 2014-02-09; просмотров: 875; Опубликованный материал нарушает авторские права? | Защита персональных данных | ЗАКАЗАТЬ РАБОТУ
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете??? 8409 — | 7321 — или читать все…
Читайте также:
Источник
Растворимость
газов (He,
Ne,
H2),
молекулы которых имеют небольшие
размеры, весьма мала. Растворимость
благородных газов резко возрастает с
увеличением их молекулярной массы.
Газы, молекулы
которых образуют водородные связи и
химические соединения с молекулами
воды, растворяются весьма хорошо (CO2,
Cl,
H2S,
SO2,
NH3).
Рассмотрим зависмость
растворимости газов от давления
(рис.1.3.15 и 1.3.16). При давлениях, близких
к атмосферному, растворимость газов в
воде растет обычно пропорционально
давлению. При повышенных давлениях
такая зависимость соблюдается для
легких газов (водород, гелий) с
удовлетворительной точностью до 10 Мпа.
При более высоких давлениях растворимость
ниже, чем должно быть по линейной
зависимости. Рост растворимости тяжелых
углеводородных газов (этан и т.д.)
замедляется уже при сравнительно
невысоких давлениях.
Зависимость
растворимости газов в воде от температуры
так же неоднозначна. В области низких
и умеренных температур оастворимость
уменьшается с температурой (рис.1.3.17). С
повышением температуры растворимость
после минимального значения снова
начинает расти (рис.1.3.15, 1.3.16).
Минимум растворимости
для наиболее легких газов (гелий, водород,
неон) наблюдается при температуре до
50 оС,
для азота — около 75оС,
для аргона, кислорода, криптона, метана,
этана — при температуре 90-100оС,
для диоксида углерода — около 150оС,
для сероводорода — примерно 180оС.
Для полярного газа, образующего
эффективные водородные связи с водой,
аммиака признаков приближения минимума
растворимости не наблюдается при
исследованиях до 318оС.
Наличие отрицательного
коэффициента растворимости и минимума
растворимости газов в воде используется
для дегазации — удаления из питательной
воды агрессивных газов (O2,
CO2).
При нагреве воды в деаэраторе до
температуры кипения парциальное давление
газов над поверхностью воды снижается
до нуля и газы переходят из воды в газовую
среду. Выделяющиеся газы вместе с частью
водяного пара непрерывно удаляются из
деаэратора.
Наиболее эффективно
удаление газов из воды происходит при
температуре кипения, соответствующей
минимуму растворимости данного газа.
В деаэраторах атмосферного типа (р =
0.12 МПа, ts
= 104оС)
происходит эффективное удаление
кислорода, а в деаэраторах повышенного
давления (р = 0.7 Мпа, ts
= 165оC)
— диоксида углерода (CO2).
1.4. Переход примесей из воды в насыщенный пар
С питательной водой
в паровой котел поступают различного
рода примеси. В барабанных и прямоточных
котлах докритического давле-ния
происходит испарение воды, пар
перегревается и направляется в турбину.
Какое количество примеси переходит в
пар? Аналогично — в деаэраторе происходит
кипение воды, имеются области жидкой и
паровой фаз.
В турбине,
подогревателях высокого и низкого
давления со стороны греющего пара и
других установках происходит обратный
процесс — конденсация водяных паров,
присутствуют так же две фазы воды
(жидкая, паровая). Здесь опять возникает
вопрос о распределении примеси между
водой и паром.
Рассмотрим систему
(рис.1.4.1), включающую жидкую (вода) и
паровую фазы, находящиеся в тепловом
равновесии: температура Т и давление р
фаз одинаковы; подвода и отвода теплоты
нет. Соотношение Т и р отвечает линии
кипения для воды.
Обозначения: верхний
штрих показывает, что данная величина
относится к жидкой фазе; два верхних
штриха — к паровой фазе.
В жидкой и паровой
фазах присутствуют примеси (i
= 1 — N),
мольная доля их xi.
Принимаем, что растворы идеальные,
наличие других примесей не оказывает
влияние на поведение i-ой
примеси.
Электрохимический
потенциал i-ой
примеси в жидкой фазе
μi’
= μi0′(p,T)
+ RTlnxi’
— (αeφ)i’,
(1)
где μi0′(p,T)
— стандартное значение химического
потенциала i-ой
примеси в жидкой фазе.
Электрохимический
потенциал в паровой фазе
μi»
= μi0″(p,T)
+ RTlnxi»
— (αeφ)i».
(2)
При равновесии
системы μi’
= μi».
На рис.1.4.2 показано
изменение химических потенциалов
примеси в жидкой и паровой фазах. Из
рис.1.4.2 видно, что при их равенстве
мольные доли i-го
вещества в жидкой и паровой фазах xi’
и xi»
различаются.
Приравняем (1) и
(2):
μi0″(p,T)
+ RTlnxi»
— (αeφ)i»
= μi0′(p,T)
+ RTlnxi’
— (αeφ)i’
.
Отсюда:
RTln(xi»/
xi’)
= -( μi0″(p,T)
— μi0′(p,T))
— ((αeφ)i’
— (αeφ)i»).
(3)
Введем обозначение
xi»/
xi’
= Кр.
(4)
Величина Кр
показывает отношение концентрации
примеси в паровой фазе к концентрации
в жидкой фазе. Называется она коэффициентом
распределения примеси между жидкой и
паравой фазами.
Коэффициент
распределения может рассчитываться не
только через мольные доли вещества, но
и через концентрации, выраженные в
других единицах 9г/кг, мкг/кг, см3/г
и т.д.). В общем виде
Кр
= сп/св,
где сп,
св
— концентрация примеси в паровой и жидкой
фазах.
Из соотношения (3)
получим зависимость для расчета
коэффициента распределения
Кр
= exp(-(μi0″
— μi0′)/RT)*exp(-((αeφ)i’
— (αeφ)i»)/RT).
(5)
Коэффициент
распределения является функцией
температуры (давления), свойств
растворенного вещества, степени
диссоциации его, состава раствора.
Рассмотрим случай,
когда растворенное вещество находится
в молекулярной форме (степень диссоциации
α = 0) в жидкой и паровой фазах. Коэффициент
распределения обозначим Крм.
Он будет опреде-ляться из выражения
Крм
= exp(-(μi0″
— μi0′)/RT).
(6)
Обозначим
Δμисп0(Т)
= μi0″(p,T)
— μi0′(p,T),
(7)
где Δμисп0(Т)
— изменение стандартных химических
потенциалов при испарении или конденсации
вещества.
Тогда
Крм
= exp(-Δμисп0(Т)/RT)
или
lnKрм
= — Δμисп0(Т)/RT.
(8)
Изменение стандартных
химических потенциалов выразим через
разность энтальпии hi’;
hi»
и энтропии si’;
si»:
Δhиспi
= hi»
— hi’;
Δsиспi
= si»
— si’;
Δμисп0
= Δhиспi
-T
Δsиспi
. (9)
Обратите внимание,
что величины hi»,
hi’,
Δhиспi,
si»,
si’,
Δsиспi,
Δμисп0
относятся к растворенному веществу
при данной температуре системы Т, а не
к водному теплоносителю.
Давлению
рассматриваемой системы р отвечает
температура кипения растворенного i-го
вещества Тиспi,отличающаяся
от темпера-туры системы Т, которая
принимается, как было указано выше, по
кривой испарения для воды (рис.1.4.3).
При Тиспi
Δμисп0
= 0 и Δsиспi
= Δhиспi/
Тиспi
.
Тогда
Δμисп0
= Δhиспi(1
— Т/Тиспi).
Молекулярный
коэффициент распределения
lnКрм
= — Δhиспi(1/Т
— 1/Тиспi)/R.
(10)
Проведем анализ
полученной зависимости (10).
Процесс испарения
жидкости всегда происходит с подводом
теплоты, т.е. Δhиспi
> 0/
Для неорганических
веществ при данном давлении системы р
температура кипения Ткипi
больше температуры кипения воды Т, при
этом, как видно из (10), lnКрм
< 0. Для газов, наоборот, Ткипi
< T,
а lnКрм
> 0.
Уравнение (10)
получено для идеальных растворов в воде
и паровой фазе, без учета влияния свойств
растворителя. Однако, с повышением
давления (температуры) двухфазной
системы плотность воды снижается, а
пара — увеличивается, паровая и жидкая
фазы воды по своим характеристикам
сближаются, в критической точке различие
между ними исчезает (табл.1).
Следовательно,
коэффициент распределения в критической
точке системы для всех веществ равен 1
(lnКрм
= 0). С учетом этого на рис.1.4.5 показан ход
зависимости коэффициента распределения
для неорганических и газообразных
веществ.
Факт, что коэффициент
распределения для газообразных веществ
больше 1, используется в деаэраторе для
удаления из воды значи-тельной части
растворенных газов.
Влияние степени
диссоциации вещества на коэффициент
распределения примеси между водой и
паром видно из формулы (5)
Кр
= Крмexp(-((αeφ)i’
— (αeφ)i»)/RT)
= = Крмexp(-(αeφ)i’
/RT) exp((αeφ)i»/RT).
(10)
При увеличении
степенидиссоциации вещества в жидкой
фазе αi’
коэффициент распределения уменьшается,
а в паровой фазе αi»
— увеличивается. При αi’
= 1 и αi»
= 1 из (10) получим значение для ионного
коэффициента распределения Кри.
Поскольку в паровой фазе степень
диссоциации существенно меньше, чем в
жидкой, ионный коэффициент распределения
меньше молекулярного.
Таким образом,
использование физико-химического метода
анализа двухфазных систем дает возможность
выявить основные закономерности процесса
перехода примесей из воды в насыщенный
пар.
Для практических
целей в теплоэнергетике используют
зависимость коэффициента распределения
не от температуры насыщения, а от
отношения плотностей воды ρ’ и пара ρ»
на линии насыщения
Крм
= (ρ»/ρ’)n
= (ρ’/ρ»)-n
. (11)
Это соотношение
впервые предложил академик Стырикович
М.А.
Использование
формулы (11) удобно тем, что в определенном
диапазоне параметров показатель степени
можно принимать постоянным. Тогда в
логарифмических координатах эта
зависимость будет линейной
lg
Крм
= — nlg(ρ’/ρ»)
, (12)
где коэффициент n
соответствует углу наклона прямой
линии.
Физически коэффициент
n
можно трактовать как координа-ционное
число растворенного в воде вещества,
показывающее, сколько молекул воды
находится в ближайшем окружении молекулы
или иона растворенного вещества. Это
число зависит от индивидуальных свойств
вещества: чем сильнее электрически
заряжена молекула (ион), тем больше
координационное число.
Из (12) видно, что
все прямые (лучи) сходятся в критической
точке, где ρ’/ρ»
= 1, Крм
= 1.
На рис.6 показана
лучевая диаграмма для ряда веществ.
Неорганические
соединения по способности растворяться
в насыщенном паре можно условно разделить
на три группы:
1 — весьма слабые
электролиты (n
< 1); они в водных растворах почти
недиссоциированы; коэффициент
распределения при р = 11 Мпа и выше
составляет десятки процентов (типа
гидратированных оксидов железа, алюминия
и т.д.);
2 — менее слабые
электролиты (n
= 1-3), коэффициент распределения при тех
же параметрах — проценты (типа
кремнекислоты);
3 — сильные электролиты
(n
> 3); практически полностью диссоциированы;
коэффициент распределения — десятые,
сотые и меньше доли процента (силикаты,
сульфаты, фосфаты натрия, кальция).
Ионные формы
растворенных веществ более гидратированы,
координационное число у них больше, а
коэффициент распределения — меньше, чем
у молекулярной формы. Видимый (интегральный)
коэффициент распределения Кр
зависит Крм,
Кри
и доли диссоциированных молекул.
Для слабых
электролитов доля молекулярной формы
в общей концентрации расворенного
вещества обозначается через β, а 1 — β —
доля ионной формы. Видимый коэффициент
распределения будет равен
Кр
= Крм
β + Кри(1
— β). (13)
Величина β зависит
не только от давления, но и от величины
рН. Поэтому при одном и том же давлении
Кр
будет различным в зависимости от величины
рН (рис.1.4.7). Видно, что Кр
для Fe3O4,
SiO2,
CuO
в широком диапазоне рН (в рабочем
диапазоне для паровых котлов) постоянен,
не зависит от рН. Объясняется это тем,
что для весьма слабых электролитов β ≈
1, 1 — β ≈ 0, т.е. Кр
≈ Крм.
Для сильных
электролитов (соли сильных оснований
и кислот) определяется степень диссоциации
α (доля ионной формы вещества), которая
зависит от концентрации электролита и
давления (плотности), но не зависит от
величины рН. Коэффициент распределения
(видимый) выражается через степень
диссоциации в воде αв
и средние коэффициенты активности в
воде fв
и паре fп
:
Кр
= Крм(1
— αв)
+ (fв/
fп)(
αвКри)0.5.
(14)
Из (14) видно, что Кр
изменяется от значения (Кри)0.5
при αв
= 1 до Крм
при αв
= 0 (рис.1.4.8). Соответствующие лучи для
(Кри)0.5
и Крм
представлены на рис.1.4.9. При 0 < αв
< 1 зависимости для Кр
ложатся между этими лучами. Значения
(Кри)0.5
и Крм
при ρ’/ρ» = 10 (р = 12 Мпа) отличаются на 2
порядка ( в 100 раз).
Коэффициент
распределения летучих веществ между
водой и паром больше 1 (рис.1.4.10), т.е. при
кипении воды летучие вещества переходят
в пар. С одной стороны, на этом процессе
основывается деаэрация воды, но, с
другой стороны, это затрудняет поддерэание
в воде на необходимом уровне величины
рН, т.к. аммиак и летучие амины переходят
в пар.
Для правильного
выбора воднохимического режима парового
котла и внутрибарабанных устройств
надо знать соотношение между коэффициентом
распределения и влажностью насыщенного
пара ω. На рис. 1.4.11 показаны значения Кр
для разных давлений в зависимости от
«силы» электролита — показателя
координационного числа n.
Там же приведены обычные для барабанных
котлов значения влажности пара ω = 0.02 —
0.05 % ( в долях ω = 0.0002 — 0.0005).
При низком давлении
в барабане (р = 4 Мпа) коэффициент
распределения выше влажности при n
< 2 (рис.1.4.11), т.е. для весьма слабых и
некоторых слабых электролитов. К ним
относятся Fe3O4,
Al2O3,
CuO,
B2O3,
SiO2.
Продукты коррозии (Fe3O4,
Al2O3
и др.) имеют
малую растворимость в воде, поэтому
даже при высоком значении Кр
концентрация их в паре мала. Особое
значение имеет кремнекислота H2SiO3
— в воде ее заметное количество и в паре
она хорошо растворяется. Сильные
электролиты имеют Кр<<
ω и их концентация в воде особого влияния
на качество пара не оказывает, если
предусмотреть достаточно эффективную
сепарацию пара в барабане. По содержанию
SiO2
в воде устанавливается предельно
допустимое значение.
При среднем давлении
(р = 11 Мпа) весьма слабые и слабые
электролиты (n
< 3) имеют Кр>
ω
, причем для Fe3O4,
Al2O3
это превышение
составляет примерно 3 порядка, для SiO2
— два порядка. Сильные электролиты имеют
еще Кр<
ω
. Для этого давления становится актуальным
для получения чистого пара снижение
концентрации слабых электролитов в
воде, улучшение сепарации и промывки
пара ( от кремнекислоты, продуктов
коррозии).
При высоком давлении
в барабане (р = 15.5 МПа) только очень
сильные электролиты (n
> 5) имеют коэффициент распределения
Кр
ниже, чем влажность пара, т.е. в насыщенный
пар основное количество примесей
поступает не с влажностью пара, а путем
их растворения. Отсюда возникает задача
обязательной промывки пара водой более
чистой, чем котловая. Но при этом не
следует принижать роль сепарации —
котловой воде часто содержатся не только
растворенные примеси, но и взвеси, шлам
с концентацией сввзв.
Эта часть примеси уносится вместе
скаплями воды и суммарное количество
примеси в насыщенном паре равно
спсум
= (свраств
+ сввзв)ω
+ свраствКр,
(15)
где свраств
— растворенная часть примеси.
Преобразуем это
выражение спсум
= ((1 + сввзв/свраств)ω
+ Кр)
свраств
= Квынсумсвраств
, (16)
где суммарный
коэффициент выноса примеси равен
Квынсум
= (1 + сввзв/свраств)ω
+ Кр
. (17)
Из полученного
выражения видно, что при наличии в
котловой воде взвешенных примесей роль
сепарации влаги от пара возрастает.
Соседние файлы в папке Лекции (word)
- #
- #
- #
- #
- #
- #
- #
Источник


