Хлор при повышенном давлении
В экстренных ситуациях пациентам с повышенным давлением врачи скорой помощи делают «горячие уколы». Необходимость в них появляется, когда чересчур повышается артериальное давление (наступает гипертонический криз). Такой подход ― эффективный способ преодоления кризиса, но колют уколы только в крайних случаях.

Что такое горячая инъекция, каков состав уколов от давления?
Сам «горячий укол» представляет собой шприц с лекарством, в котором содержатся органические или неорганические соли. При введении ощущения похожи на, что в вену ввели нечто подогретое. Это вызвано действием солей: сосуды расширяются, а свободная циркуляция крови способствует быстрому согреванию организма. Подобные уколы назначают для купирования криза (при высоком давлении), а также для предупреждения опасных осложнений. Но использование этого метода нормализации состояния есть определенные риски, так как неизвестно, как отреагирует организм на препарат, каковыми разовьются побочные эффекты. В кризисных ситуациях времени мало, поэтому врачам нужно уметь мгновенно распознать, какой же препарат необходим пациенту.
Горячим уколом считается введение в вену кальций хлорид в виде 10-процентного раствора. Вводят его осторожно, примерно 4―5 минут. «Магнезия» тоже называется горячей инъекцией. Она состоит из магния сульфата, но используют как экстренная помощь. Нормой для взрослого считается объем в 10 мл. Для смягчения боли при введении в состав добавляют «Новокаин». Используется и глюконат кальция. В случае удачного купирования криза, необходимо проконсультироваться с кардиологом по поводу дальнейшего лечения.
Вернуться к оглавлению
Когда назначают?
 При недостаточной эффективности таблеток применяют уколы.
При недостаточной эффективности таблеток применяют уколы.
Показания для использования быстродействующей инъекции, называемой «горячий укол», ― резкие повышения артериального давления или кризы. При менее выраженном повышении давления показаны препараты более медленного воздействия (до часа). После удачного купирования криза, есть шанс избежать возможных его повторений в будущем.
Каждый из препаратов применяется и при других заболеваниях. Раствор глюконата кальция используют во время аллергий, при болезнях сердечно-сосудистой системы, при высыпаниях на коже или для купирования воспалительных процессов. Им же пополняют в организме недостаток кальция. Хлористый кальций назначают в случае болезни почек, кишечника или печени. Он помогает при аллергических заболеваниях, полезен при восполнении кальция в организме, а иногда и используется как препарат от шока. «Магнезию» же назначают:
- беременным для сохранения плода;
- при дефиците магния;
- при застое мочи;
- когда обнаружена тахикардия;
- при отравлениях, в том числе при тяжелых;
- на фоне нехватке кислорода в тканях мозга (гипоксии);
- при эпилепсии.
Вернуться к оглавлению
Чем и как делают?
 Лучше всего вводить препарат внутривенно – это наиболее безопасно и эффективно.
Лучше всего вводить препарат внутривенно – это наиболее безопасно и эффективно.
Вводят лекарство тремя разными способами:
- прямо в вену;
- внутримышечно;
- внутрисердечно, когда лекарство вводят в определенную зону (область желудочка).
Горячий укол ― процедура, при которой доктор вводит в вену, мышцу или же в четко определенную область конкретный раствор. Процесс занимает около 4―5-ти минут, поскольку укол делается медленно и максимально осторожно. Игла для процедуры обязательно нужна тонкая и длинная (4 см), чтобы избежать негативных последствий и осложнений. Растворы выводят лишнюю жидкость, расширяют сосуды и ускоряют процесс продвижения крови по тканям и органам. Во время внутримышечного введения, ампулу с препаратом нагревают до температуры тела и вводят в определенную зону — верхнюю часть ягодицы.
Вернуться к оглавлению
Другие препараты
Среди других инъекций от давления, также есть негорячие. Их описание сведено в таблицу:
| Другие инъекции | |
|---|---|
| Название | Действие |
| «Диабизол» | Уменьшает венозный возврат крови и сердечный выброс. Плавно снижает артериальное давление, уменьшает общее периферическое сопротивление. Эффективность повышается при комбинировании с «Седуксеном». |
| «Рауседил» | Эффективен при сильных психоэмоциональных возбуждениях. Действие наступает спустя 40―50 минут. Может провоцировать что-то вроде застоя в нервной системе (слабость, торможение). Маскирует развивающиеся нарушения обращения крови в мозгу. |
| «Дроперидол» | Эффективен при слабой симптоматике. Прекрасное средство от озноба, тошноты, чувства страха и дрожи. Вызывает сонливость, а передозировка — нейровегетативную заторможенность. Сочетается с «Дибазолом». |
| «Аминазин» | Не рекомендован по причине неуправляемости. Вызывает ухудшения в функционировании дыхательной системы, тахикардию, чрезмерно снижает артериальное давление после введения в вену. |
| Бета-адреноблокираторы | Не рекомендуют использовать для купирования гипертонического криза из-за неэффективности при снижении сосудистого сопротивления. Комбинируют с раствором «Пентамина». |
Вернуться к оглавлению
Противопоказания
Поскольку препарат назначают при нарушениях всасывания кальция, горячие уколы не ставят людям с переизбытком кальция в организме. Его растворы противопоказаны к применению при индивидуальной непереносимости, сердечной, почечной, дыхательной недостаточностях и поздних сроках беременности. Что насчет магнезии, ее противопоказания ― пониженное давление и пульс, прием других препаратов с кальцием и последние недели беременности.
Источник

Рассмотрены физические свойства хлора: плотность хлора, его теплопроводность, удельная теплоемкость и динамическая вязкость при различных температурах. Физические свойства Cl2 представлены в виде таблиц для жидкого, твердого и газообразного состояния этого галогена.
Основные физические свойства хлора
Хлор входит в VII группу третьего периода периодической системы элементов под номером 17. Он относится к подгруппе галогенов, имеет относительные атомную и молекулярные массы 35,453 и 70,906, соответственно. При температурах выше -30°С хлор представляет собой зеленовато-желтый газ с характерным резким раздражающим запахом. Он легко сжижается под обычным давлением (1,013·105 Па), будучи охлажден до -34°С, и образует прозрачную жидкость янтарного цвета, затвердевающую при температуре -101°С.
Из-за своей высокой химической активности свободный хлор не встречается в природе, а существует только в форме соединений. Он содержится главным образом в минерале галите (хлорид натрия NaCl), также входит в состав таких минералов, как: сильвин (KCl), карналлит (KCl·MgCl2·6H2O) и сильвинит (KCl·NaCl). Содержание хлора в земной коре приближается к 0,02% от общего числа атомов земной коры, где он находится в виде двух изотопов 35Cl и 37Cl в процентном соотношении 75,77% 35Cl и 24,23% 37Cl.
| Свойство | Значение |
|---|---|
| Температура плавления, °С | -100,5 |
| Температура кипения, °С | -30,04 |
| Критическая температура, °С | 144 |
| Критическое давление, Па | 77,1·105 |
| Критическая плотность, кг/м3 | 573 |
| Плотность газа (при 0°С и 1,013·105 Па), кг/м3 | 3,214 |
| Плотность насыщенного пара (при 0°С и 3,664·105 Па), кг/м3 | 12,08 |
| Плотность жидкого хлора (при 0°С и 3,664·105 Па), кг/м3 | 1468 |
| Плотность жидкого хлора (при 15,6°С и 6,08·105 Па), кг/м3 | 1422 |
| Плотность твердого хлора (при -102°С), кг/м3 | 1900 |
| Относительная плотность по воздуху газа (при 0°С и 1,013·105 Па) | 2,482 |
| Относительная плотность по воздуху насыщенного пара (при 0°С и 3,664·105 Па) | 9,337 |
| Относительная плотность жидкого хлора при 0°С (по воде при 4°С) | 1,468 |
| Удельный объем газа (при 0°С и 1,013·105 Па), м3/кг | 0,3116 |
| Удельный объем насыщенного пара (при 0°С и 3,664·105 Па), м3/кг | 0,0828 |
| Удельный объем жидкого хлора (при 0°С и 3,664·105 Па), м3/кг | 0,00068 |
| Давление паров хлора при 0°С, Па | 3,664·105 |
| Динамическая вязкость газа при 20°С, 10-3 Па·с | 0,013 |
| Динамическая вязкость жидкого хлора при 20°С, 10-3 Па·с | 0,345 |
| Теплота плавления твердого хлора (при температуре плавления), кДж/кг | 90,3 |
| Теплота парообразования (при температуре кипения), кДж/кг | 288 |
| Теплота сублимации (при температуре плавления), кДж/моль | 29,16 |
| Молярная теплоемкость Cp газа (при -73…5727°С), Дж/(моль·К) | 31,7…40,6 |
| Молярная теплоемкость Cp жидкого хлора (при -101…-34°С), Дж/(моль·К) | 67,1…65,7 |
| Коэффициент теплопроводности газа при 0°С, Вт/(м·К) | 0,008 |
| Коэффициент теплопроводности жидкого хлора при 30°С, Вт/(м·К) | 0,62 |
| Энтальпия газа, кДж/кг | 1,377 |
| Энтальпия насыщенного пара, кДж/кг | 1,306 |
| Энтальпия жидкого хлора, кДж/кг | 0,879 |
| Показатель преломления при 14°С | 1,367 |
| Удельная электропроводность при -70°С, См/м | 10-18 |
| Сродство к электрону, кДж/моль | 357 |
| Энергия ионизации, кДж/моль | 1260 |
Плотность хлора
При нормальных условиях хлор представляет собой тяжелый газ, плотность которого приблизительно в 2,5 раза выше плотности воздуха. Плотность газообразного и жидкого хлора при нормальных условиях (при 0°С) равна, соответственно 3,214 и 1468 кг/м3. При нагревании жидкого или газообразного хлора его плотность снижается из-за увеличения объема вследствие теплового расширения.
Плотность газообразного хлора
В таблице представлены значения плотности хлора в газообразном состоянии при различных температурах (в интервале от -30 до 140°С) и нормальном атмосферном давлении (1,013·105 Па). Плотность хлора меняется с изменением температуры — при нагревании она уменьшается. Например, при 20°С плотность хлора равна 2,985 кг/м3, а при повышении температуры этого газа до 100°С, величина плотности снижается до значения 2,328 кг/м3.
| t, °С | ρ, кг/м3 | t, °С | ρ, кг/м3 |
|---|---|---|---|
| -30 | 3,722 | 60 | 2,616 |
| -20 | 3,502 | 70 | 2,538 |
| -10 | 3,347 | 80 | 2,464 |
| 3,214 | 90 | 2,394 | |
| 10 | 3,095 | 100 | 2,328 |
| 20 | 2,985 | 110 | 2,266 |
| 30 | 2,884 | 120 | 2,207 |
| 40 | 2,789 | 130 | 2,15 |
| 50 | 2,7 | 140 | 2,097 |
При росте давления плотность хлора увеличивается. Ниже в таблицах приведена плотность газообразного хлора в интервале температуры от -40 до 140°С и давлении от 26,6·105 до 213·105 Па. С повышением давления плотность хлора в газообразном состоянии увеличивается пропорционально. Например, увеличение давления хлора с 53,2·105 до 106,4·105 Па при температуре 10°С приводит к двукратному увеличению плотности этого газа.
| ↓ t, °С | P, кПа → | 26,6 | 53,2 | 79,8 | 101,3 |
|---|---|---|---|---|
| -40 | 0,9819 | 1,996 | — | — |
| -30 | 0,9402 | 1,896 | 2,885 | 3,722 |
| -20 | 0,9024 | 1,815 | 2,743 | 3,502 |
| -10 | 0,8678 | 1,743 | 2,629 | 3,347 |
| 0,8358 | 1,678 | 2,528 | 3,214 | |
| 10 | 0,8061 | 1,618 | 2,435 | 3,095 |
| 20 | 0,7783 | 1,563 | 2,35 | 2,985 |
| 30 | 0,7524 | 1,509 | 2,271 | 2,884 |
| 40 | 0,7282 | 1,46 | 2,197 | 2,789 |
| 50 | 0,7055 | 1,415 | 2,127 | 2,7 |
| 60 | 0,6842 | 1,371 | 2,062 | 2,616 |
| 70 | 0,6641 | 1,331 | 2 | 2,538 |
| 80 | 0,6451 | 1,292 | 1,942 | 2,464 |
| 90 | 0,6272 | 1,256 | 1,888 | 2,394 |
| 100 | 0,6103 | 1,222 | 1,836 | 2,328 |
| 110 | 0,5943 | 1,19 | 1,787 | 2,266 |
| 120 | 0,579 | 1,159 | 1,741 | 2,207 |
| 130 | 0,5646 | 1,13 | 1,697 | 2,15 |
| 140 | 0,5508 | 1,102 | 1,655 | 2,097 |
| ↓ t, °С | P, кПа → | 133 | 160 | 186 | 213 |
|---|---|---|---|---|
| -20 | 4,695 | 5,768 | — | — |
| -10 | 4,446 | 5,389 | 6,366 | 7,389 |
| 4,255 | 5,138 | 6,036 | 6,954 | |
| 10 | 4,092 | 4,933 | 5,783 | 6,645 |
| 20 | 3,945 | 4,751 | 5,565 | 6,385 |
| 30 | 3,809 | 4,585 | 5,367 | 6,154 |
| 40 | 3,682 | 4,431 | 5,184 | 5,942 |
| 50 | 3,563 | 4,287 | 5,014 | 5,745 |
| 60 | 3,452 | 4,151 | 4,855 | 5,561 |
| 70 | 3,347 | 4,025 | 4,705 | 5,388 |
| 80 | 3,248 | 3,905 | 4,564 | 5,225 |
| 90 | 3,156 | 3,793 | 4,432 | 5,073 |
| 100 | 3,068 | 3,687 | 4,307 | 4,929 |
| 110 | 2,985 | 3,587 | 4,189 | 4,793 |
| 120 | 2,907 | 3,492 | 4,078 | 4,665 |
| 130 | 2,832 | 3,397 | 3,972 | 4,543 |
| 140 | 2,761 | 3,319 | 3,87 | 4,426 |
Плотность жидкого хлора
Жидкий хлор может существовать в относительно узком температурном диапазоне, границы которого лежат от минус 100,5 до плюс 144°С (то есть от температуры плавления до критической температуры). Выше температуры 144°С хлор не перейдет в жидкое состояние ни при каком давлении. Плотность жидкого хлора в этом температурном интервале изменяется от 1717 до 573 кг/м3.
| t, °С | ρ, кг/м3 | t, °С | ρ, кг/м3 |
|---|---|---|---|
| -100 | 1717 | 30 | 1377 |
| -90 | 1694 | 40 | 1344 |
| -80 | 1673 | 50 | 1310 |
| -70 | 1646 | 60 | 1275 |
| -60 | 1622 | 70 | 1240 |
| -50 | 1598 | 80 | 1199 |
| -40 | 1574 | 90 | 1156 |
| -30 | 1550 | 100 | 1109 |
| -20 | 1524 | 110 | 1059 |
| -10 | 1496 | 120 | 998 |
| 1468 | 130 | 920 | |
| 10 | 1438 | 140 | 750 |
| 20 | 1408 | 144 | 573 |
Удельная теплоемкость хлора
Удельная теплоемкость газообразного хлора Cp в размерности кДж/(кг·К) в интервале температуры от 0 до 1200°С и нормальном атмосферном давлении может быть рассчитана по формуле:
![]()
где T — абсолютная температура хлора в градусах Кельвина.
Следует отметить, что при нормальных условиях удельная теплоемкость хлора имеет значение 471 Дж/(кг·К) и при нагревании увеличивается. Рост теплоемкости при температурах выше 500°С становится незначительным, и при высоких температурах удельная теплоемкость хлора практически не изменяется.
В таблице приведены результаты расчета удельной теплоемкости хлора по указанной выше формуле (погрешность расчета составляет около 1%).
| t, °С | Cp, Дж/(кг·К) | t, °С | Cp, Дж/(кг·К) |
|---|---|---|---|
| 471 | 250 | 506 | |
| 10 | 474 | 300 | 508 |
| 20 | 477 | 350 | 510 |
| 30 | 480 | 400 | 511 |
| 40 | 482 | 450 | 512 |
| 50 | 485 | 500 | 513 |
| 60 | 487 | 550 | 514 |
| 70 | 488 | 600 | 514 |
| 80 | 490 | 650 | 515 |
| 90 | 492 | 700 | 515 |
| 100 | 493 | 750 | 515 |
| 110 | 494 | 800 | 516 |
| 120 | 496 | 850 | 516 |
| 130 | 497 | 900 | 516 |
| 140 | 498 | 950 | 516 |
| 150 | 499 | 1000 | 517 |
| 200 | 503 | 1100 | 517 |
При температуре близкой к абсолютному нулю хлор находится в твердом состоянии и имеет низкую величину удельной теплоемкости (19 Дж/(кг·К)). По мере увеличения температуры твердого Cl2 его теплоемкость растет и достигает при минус 143°С величины 720 Дж/(кг·К).
Жидкий хлор имеет удельную теплоемкость 918…949 Дж/(кг·К) в интервале от 0 до -90 градусов Цельсия. По данным таблицы видно, что удельная теплоемкость жидкого хлора выше чем газообразного и при увеличении температуры снижается.
| Твердый хлор | Жидкий хлор | ||
|---|---|---|---|
| t, °С | Cp, Дж/(кг·К) | t, °С | Cp, Дж/(кг·К) |
| -273 | 19 | -90 | 949 |
| -269 | 209 | -80 | 944 |
| -243 | 315 | -70 | 935 |
| -193 | 595 | -30 | 929 |
| -143 | 720 | 918 | |
Теплопроводность хлора
В таблице представлены значения коэффициентов теплопроводности газообразного хлора при нормальном атмосферном давлении в интервале температуры от -70 до 400°С.
Коэффициент теплопроводности хлора при нормальных условиях составляет 0,0079 Вт/(м·град), что в 3 раза меньше чем у воздуха при тех же температуре и давлении. Нагревание хлора приводит к повышению его теплопроводности. Так, при температуре 100°С, значение этого физического свойства хлора увеличивается до 0,0114 Вт/(м·град).
| t, °С | λ, Вт/(м·град) | t, °С | λ, Вт/(м·град) |
|---|---|---|---|
| -70 | 0,0054 | 50 | 0,0096 |
| -60 | 0,0058 | 60 | 0,01 |
| -50 | 0,0062 | 70 | 0,0104 |
| -40 | 0,0065 | 80 | 0,0107 |
| -30 | 0,0068 | 90 | 0,0111 |
| -20 | 0,0072 | 100 | 0,0114 |
| -10 | 0,0076 | 150 | 0,0133 |
| 0,0079 | 200 | 0,0149 | |
| 10 | 0,0082 | 250 | 0,0165 |
| 20 | 0,0086 | 300 | 0,018 |
| 30 | 0,009 | 350 | 0,0195 |
| 40 | 0,0093 | 400 | 0,0207 |
Вязкость хлора
Коэффициент динамической вязкости газообразного хлора в интервале температуры 20…500°С можно приближенно вычислить по формуле:
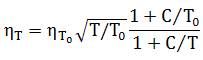
где ηT — коэффициент динамической вязкости хлора при заданной температуре T, К;
ηT0 — коэффициент динамической вязкости хлора при температуре T0=273 К (при н. у.);
С — константа Сюзерленда (для хлора С=351).
При нормальных условиях динамическая вязкость хлора равна 0,0123·10-3 Па·с. При нагревании такое физическое свойство хлора, как вязкость, принимает более высокие значения.
| t, °С | η, 10-3 Па·с | t, °С | η, 10-3 Па·с |
|---|---|---|---|
| 0,0123 | 200 | 0,0209 | |
| 20 | 0,0133 | 250 | 0,0229 |
| 25 | 0,0136 | 300 | 0,0249 |
| 50 | 0,0147 | 400 | 0,0287 |
| 100 | 0,0168 | 500 | 0,0333 |
| 150 | 0,0189 | 600 | 0,0373 |
Жидкий хлор имеет вязкость на порядок выше, чем газообразный. Например, при температуре 20°С динамическая вязкость жидкого хлора имеет величину 0,345·10-3 Па·с и при росте температуры снижается.
| t, °С | η, 10-3 Па·с | t, °С | η, 10-3 Па·с |
|---|---|---|---|
| -53 | 0,569 | 20 | 0,345 |
| -45 | 0,53 | 35 | 0,323 |
| -35 | 0,494 | 50 | 0,3 |
| 0,385 | 75 | 0,275 | |
| 10 | 0,365 | 100 | 0,249 |
Источники:
- Барков С. А. Галогены и подгруппа марганца. Элементы VII группы периодической системы Д. И. Менделеева. Пособие для учащихся. М.: Просвещение, 1976 — 112 с.
- Варгафтик Н. Б. Справочник по теплофизическим свойствам газов и жидкостей.
- Таблицы физических величин. Справочник. Под ред. акад. И. К. Кикоина. М.: Атомиздат, 1976 — 1008 с.
- Якименко Л. М., Пасманик М. И. Справочник по производству хлора, каустической соды и основных хлорпродуктов. Изд. 2-е, пер. и др. М.: Химия, 1976 — 440 с.
Источник
Хлор относится к группе галогенов. Молекулярная масса хлора — 70,9.
При нормальных условиях хлор представляет собой газ зеленовато-желтого цвета с резким раздражающим запахом. В сжиженном состоянии хлор может находиться только при избыточном давлении или при температуре ниже минус 34 °С. Хранится и транспортируется жидкий хлор в сосудах, выдерживающих избыточное давление. Давление насыщенных паров хлора в сосуде зависит от температуры и с ее повышением увеличивается. Зависимость давления насыщенных паров хлора в сосуде от температуры приведена в таблице 1.
Таблица 1
| Температура хлора, °С | -40 | -30 | -20 | -10 | ||||||
| Давление, ата | 0,79 | 1,24 | 1,85 | 2,68 | 3,76 | 5,14 | 6,86 | 8,97 | 11,52 | 14,55 |
Плотность жидкого хлора при температуре кипения (-34 °С) составляет 1560 кг/м3.
При испарении одного объема жидкого хлора при 0 °С образуется 457 объемов газообразного хлора. Газообразный хлор тяжелее воздуха в 2,5 раза, поэтому при аварийных утечках он стелется по низу, создавая устойчивое газовое облако. Плотность хлоргаза при 0 °С и давлении 101,3 кПа равна 3,21 кг/м3.
Хлор, полученный в электролизерах, может содержать крайне опасную примесь — трихлорид азота (NCl3). Последний представляет собой тяжелую маслянистую жидкость с неприятным запахом, напоминающим запах хлора. Плотность NCl3 – 1,65 кг/л; температура кипения 71 °С. Трихлорид азота является взрывчатым веществом, обладающим чрезвычайно высокой чувствительностью к удару, трению и нагреванию. Наличие в хлоре трихлорида азота может послужить причиной хлопков и взрывов трубопроводов, ресиверов, испарителей и тары для хранения и транспортирования жидкого хлора.
Хлопки и взрывы на ряде предприятий химической промышленности, цветной металлургии, в хлорном хозяйстве станций водоподготовки сопровождались, как правило, выбросом больших количеств хлора в окружающую среду. Учитывая взрывоопасные свойства трихлорида азота, ГОСТ 6718-93 допускает его содержание в жидком хлоре первого сорта не более 0,004% (по массе).
Хлор является сильным окислителем. Не горюч. Реагирует с большинством органических соединений, в ряде случаев со взрывом. Смесь хлора с водородом под действием света взрывается.
Хлор оказывает различное коррозионное воздействие на конструкционные материалы в зависимости оттого, «влажный» он или «сухой». В присутствии влаги протекает обратимая реакция гидролиза хлора с образованием соляной и хлорноватистой кислот:
Сl2 + Н2O « НСl + НсlO
Кроме этой реакции, в определенных условиях протекают одновременно реакции с образованием хлорноватой кислоты (НСlO3), хлоридов железа, водорода и кислорода. Поэтому во «влажном хлоре» (содержание воды > 0,04% масс.) углеродистые и низколегированные стали подвергаются точечной и язвенной коррозии, а в герметичных сосудах (например, в хлорных контейнерах) повышается вероятность образования взрывоопасных смесей водорода с кислородом и хлором.
Для изготовления технологического и трубопроводного оборудования, эксплуатируемого во «влажном хлоре» (теплообменники, насосы, трубопроводы, арматура и др.) используют титан, который не взаимодействует с «влажным хлором» даже при повышенной температуре (100 °С). Однако следует иметь в виду, что с «сухим» газообразным и жидким хлором (содержание воды менее 0,04% масс.) титан реагирует очень бурно, вплоть до самовозгорания и взрыва.
С углеродистыми и низколегированными сталями «сухой хлор» практически не взаимодействует до температуры 100 °С.
Дата публикования: 2015-07-22; Прочитано: 794 | Нарушение авторского права страницы | Заказать написание работы
studopedia.org — Студопедия.Орг — 2014-2019 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования
(0.001 с)…![]()
Источник
Хлор относится к группе галогенов. Молекулярная масса хлора — 70,9.
При нормальных условиях хлор представляет собой газ зеленовато-желтого цвета с резким раздражающим запахом. В сжиженном состоянии хлор может находиться только при избыточном давлении или при температуре ниже минус 34 °С. Хранится и транспортируется жидкий хлор в сосудах, выдерживающих избыточное давление. Давление насыщенных паров хлора в сосуде зависит от температуры и с ее повышением увеличивается. Зависимость давления насыщенных паров хлора в сосуде от температуры приведена в таблице 1.1.
Таблица 1.1 — Зависимость давления насыщенных паров от температуры
Температура хлора, °С | -40 | -30 | -20 | -10 | 10 | 20 | 30 | 40 | 50 | |
Давление, ата | 0,79 | 1,24 | 1,85 | 2,68 | 3,76 | 5,14 | 6,86 | 8,97 | 11,52 | 14,55 |
Плотность жидкого хлора при температуре кипения (-34 °С) составляет 1560 кг/м3. При испарении одного объема жидкого хлора при 0 °С образуется 457 объемов газообразного хлора. Газообразный хлор тяжелее воздуха в 2,5 раза, поэтому при аварийных утечках он стелется по низу, создавая устойчивое газовое облако. Плотность хлоргаза при 0 °С и давлении 101,3 кПа равна 3,21 кг/м3.
Хлор является сильным окислителем. Не горюч. Реагирует с большинством органических соединений, в ряде случаев со взрывом. Смесь хлора с водородом под действием света взрывается.
Хлор оказывает различное коррозионное воздействие на конструкционные материалы в зависимости оттого, «влажный» он или «сухой». В присутствии влаги протекает обратимая реакция гидролиза хлора с образованием соляной и хлорноватистой кислот:
Сl2 + Н2O ?> НСl + НСlO
Кроме этой реакции, в определенных условиях протекают одновременно реакции с образованием хлорноватой кислоты (НСlO3), хлоридов железа, водорода и кислорода. Поэтому во «влажном хлоре» (содержание воды > 0,04% масс.) углеродистые и низколегированные стали подвергаются точечной и язвенной коррозии, а в герметичных сосудах (например, в хлорных контейнерах) повышается вероятность образования взрывоопасных смесей водорода с кислородом и хлором.
Для изготовления технологического и трубопроводного оборудования, эксплуатируемого во «влажном хлоре» (теплообменники, насосы, трубопроводы, арматура и др.) используют титан, который не взаимодействует с «влажным хлором» даже при повышенной температуре (100 °С). Однако следует иметь в виду, что с «сухим» газообразным и жидким хлором (содержание воды менее 0,04% масс.) титан реагирует очень бурно, вплоть до самовозгорания и взрыва.
С углеродистыми и низколегированными сталями «сухой хлор» практически не взаимодействует до температуры 100 °С.
Хлор обладает сильным токсическим и раздражающим действием. Оказывает раздражающее воздействие на глаза и органы дыхания. При вдыхании вызывает судорожный, мучительный кашель. В тяжелых случаях происходит спазм голосовых связок, отек легких. Оказывает сковывающее воздействие на центральную нервную систему.
Предельно-допустимая концентрация хлора в воздухе рабочих помещений 1 мг/м3, в атмосферном воздухе населенных мест максимально разовая — 0,1 мг/ м3, среднесуточная — 0,03 мг/ м3.
Характер действия хлора на организм человека в зависимости от его концентрации в воздухе приведен в таблице 1.2.
Таблица 1.2 — Действия хлора на организм человека в зависимости от его концентрации в воздухе
Концентрация хлора в воздухе, мг/м3 | Действие на организм человека |
3,0 | Наименьшая концентрация, вызывающая слабые симптомы раздражения после нескольких часов пребывания человека в загазованном хлором воздухе. |
10,3 | Предел восприятия — самая низкая концентрация, воспринимаемая обонянием. |
45,3 | Минимальная концентрация, вызывающая раздражение гортани. |
90,6 | Минимальная концентрация, вызывающая приступы кашля. |
1800 | Потеря сознания при вдыхании. |
3000 | Смертельная концентрация при нескольких глубоких вдохах |
Источник

