Химическое равновесие при повышенных давлениях
Обратимые и необратимые химические реакции
Химические реакции бывают обратимые и необратимые.
Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении:
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄):
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение
T | ↑Т — равновесие смещается в сторону эндотермической реакции |
| ↓Т — равновесие смещается в сторону экзотермической реакции | |
p | ↑p — равновесие смещается в сторону реакции с меньшей суммой коэффициентов перед газообразными веществами |
| ↓p — равновесие смещается в сторону реакции с большей суммой коэффициентов перед газообразными веществами | |
c | ↑c(реагента) – равновесие смещается в сторону прямой реакции (вправо) |
| ↓c(реагента) – равновесие смещается в сторону обратной реакции (влево) | |
| ↑c(продукта) – равновесие смещается в сторону обратной реакции (влево) | |
| ↓c(продукта) – равновесие смещается в сторону прямой реакции (вправо) | |
| Катализатор | На равновесие не влияет!!! |
Источник
04-Май-2013 | комментариев 6 | Лолита Окольнова
В части А ЕГЭ по химии есть задания на тему смещения химического равновесия. Это довольно простая тема обратимости химических реакций и укладывается буквально в три примера.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Мы как раз рассмотрим влияние на химическое равновесие трех факторов: концентрации, температуры и давления.
Еще в 1994 году французский химик Анри Луи Ле Шателье сформулировал общий принцип для смещения любого химического равновесия:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
Влияние концентрации на смещение химического равновесия
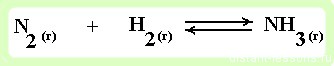
пример 1
реакция образования аммиака — протекает в газовой среде
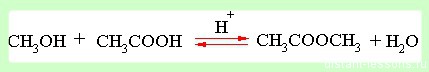 пример 2
пример 2
реакция образования сложного эфира — реакция, проходящая в жидкой среде.
- Увеличение концентрации реагентов смещает химическое равновесие в сторону продуктов реакции как в газовой, так и в жидкой среде.
- Удаление продуктов из среды реакции так же смещает равновесие в сторону продуктов реакции.
- Увеличение концентрации продуктов смещает химическое равновесие в сторону обратной реакции.
Влияние температуры на смещение химического равновесия
Все химические реакции делятся на два типа:
- Эндотермические реакции — реакции, протекающие с поглощением теплоты.
-
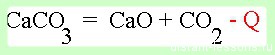
Экзотермические реакции — протекают с выделением теплоты.

Соответственно, с помощью температурного воздействия мы можем оказывать влияние на смещение химического равновесия в системе:
в эндотермической реакции:
- увеличение температуры смещает равновесие в сторону продуктов (прямой реакции);
- уменьшение температуры смещает равновесие в сторону реагентов (обратной реакции);
в экзотермической реакции:
- увеличение температуры смещает равновесие в сторону реагентов (обратной реакции);
- уменьшение температуры смещает равновесие в сторону продуктов (прямой реакции);
Влияние давления на смещение химического равновесия
Этот вопрос относится только к реакциям в газовой среде.
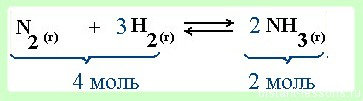
- При увеличении давления равновесие смещается в сторону меньшего объема (в данном примере 4 моль → 2 моль, т.е. равновесие сместится в сторону продукта реакции -образования аммиака).
- При уменьшении давления — в сторону большего объема (в сторону обратной реакции)
Если в реакции участвуют твердые вещества, например: 2C (тв) + O2 (г) ↔ 2CO (г), то их количество не учитывается.
Если объем (количество веществ) смеси не меняется, то изменение давления не будет оказывать влияние на смещение химического равновесия.
Катализаторы не влияют на смещение химического равновесия!
- В ЕГЭ это вопрос А21 — Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов
Тест «Химическое равновесиe»
1. В реакции 2H2 (г) + O2 (г) = 2H2O (г)
увеличение давления смещает равновесие в сторону продуктов реакции
увеличение давления смещает равновесие в сторону реагентов
уменьшение давления смещает равновесие в сторону продуктов реакции
изменение давления не влияет на равновесие данной реакции
2. В реакции H2 (г) + S (тв) = H2S (г) увеличение давления:
увеличение давления смещает равновесие в сторону продуктов реакции
увеличение давления смещает равновесие в сторону реагентов
уменьшение давления смещает равновесие в сторону продуктов реакции
изменение давления не влияет на равновесие данной реакции
3. Выберите необратимую химическую реакцию:
СH3COOH + CH3OH = CH3COOCH3
CaCO3 = CaO + CO2
NaOH + HCl = NaCl + H2O
NH3 + H2O = NH4OH
4. Для смещения равновесия в сторону продуктов реакции: C2H5OH + CH3COOH « CH3COOC2H5 +H2O-Q нужно:
добавить эфира
уменьшить концентрацию кислоты
уменьшить концентрацию спирта
нагреть
5. При повышении давления равновесие не смещается в реакции:
2H2 (г) + O2 (г) -> 2H2O (г)
С(ТВ) + О2(г) ->CO(г)
2СО(г) + O2 -> 2СО2(г)
2H2(г) + O2(г) = 2H2O(г)
6. В какой реакции повышение давления смещает равновесие в сторону реагентов?
N2(г) + О2(г) -> 2NO(г)
2NH3(г) -> N2(г) + 3H2(г)
H2(г) + Cl2(г) -> 2HCl(г)
2SO2(г) + O2(г) -> 2SО3(г)
7. Укажите необратимую реакцию:
хлорид натрия и азотная кислота
гидролиз нитрата натрия
электролиз хлорида серебра
гидроксид натрия и соляная кислота
8. В реакции цинка с соляной кислотой на смещение равновесия НЕ влияет:
увеличение концентрации кислоты
удаление из среды реакции газа
увеличение количества цинка
увеличение площади поверхности цинка
9. Утверждение: «Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации»:
неверно
верно
10. Утверждение: «Химические реакции, которые протекают со сравнимыми скоростями в обоих направлениях, называются обратимыми»Ж
верно
неверно
Обсуждение: «Смещение химического равновесия»
(Правила комментирования)
Источник
1.
Среди всех известных реакций различают реакции обратимые и
необратимые. При изучении реакций ионного обмена были перечислены условия, при
которых они протекают до конца. (вспомните
их).
Известны и такие реакции, которые при данных
условиях до конца не идут. Так, например, при растворении в воде сернистого
газа происходит реакция: SO2
+ H2O → H2SO3. Но оказывается,
что в водном растворе может образоваться только определенное количество
сернистой кислоты. Это объясняется тем, что сернистая кислота непрочная, и
происходит обратная реакция, т.е. разложение на оксид серы и воду.
Следовательно, данная реакция не идет до конца потому, что одновременно происходит
две реакции – прямая (между оксидом
серы и водой) и обратная (разложение
сернистой кислоты). SO2
+ H2O ↔ H2SO3.
Химические реакции, протекающие при данных
условиях во взаимно противоположных направлениях, называются обратимыми.
2.
Поскольку скорость химических реакций зависит
от концентрации реагирующих веществ, то вначале скорость прямой реакции (υпр ) должна быть максимальной, а скорость обратной реакции (υобр) равняется нулю. Концентрация реагирующих
веществ с течением времени уменьшается, а концентрация продуктов реакции
увеличивается. Поэтому скорость прямой реакции уменьшается, а скорость обратной
реакции увеличивается. В определенный момент времени скорость прямой и обратной
реакций становятся равными:
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия:
υпр = υобр
Состояние системы, при
котором скорость прямой реакции равна скорости обратной реакции, называют
химическим равновесием.
В состоянии химического
равновесия количественное соотношение между реагирующими веществами и
продуктами реакции остается постоянным: сколько молекул продукта реакции в
единицу времени образуется, столько их и разлагается. Однако состояние
химического равновесия сохраняется до тех пор, пока остаются неизменными
условия реакции: концентрация, температура и давление.
Количественно
состояние химического равновесия описывается законом действующих масс.
При равновесии отношение
произведения концентраций продуктов реакции (в степенях их коэффициентов) к
произведению концентраций реагентов (тоже в степенях их коэффициентов) есть
величина постоянная, не зависящая от исходных концентраций веществ в
реакционной смеси.
Эта постоянная величина называется константой
равновесия — k
Так для реакции: N2 (Г) + 3H2 (Г) ↔ 2NH3 (Г) + 92,4 кДж константа
равновесия выражается так:
υ1 = υ2
υ1
(прямой реакции) = k1[N2][H2]3 , где [] – равновесные молярные
концентрации, [] = моль/л
υ2(обратной
реакции)= k2 [NH3]2
k1[N2][H2]3 = k2 [NH3]2
Kp= k1/k2 = [NH3]2/ [N2][H2]3 – константа равновесия.
Химическое
равновесие зависит – от концентрации, давления, температуры.
Принцип Ле-Шателье определяет направление смешения равновесия:
Если на систему, находящуюся в равновесии
оказали внешнее воздействие, то равновесие в системе сместится в сторону
обратную этому воздействию.
1) Влияние концентрации – если увеличить концентрацию исходных
веществ, то равновесие смещается в сторону образования продуктов реакции.
Например,
Kp = k1/k2 = [NH3]2/ [N2][H2]3
При
добавлении в реакционную смесь, например азота,
т.е. возрастает концентрация реагента, знаменатель в выражении для К
увеличивается, но так как К – константа, то для выполнения этого условия должен
увеличиться и числитель. Таким образом, в реакционной смеси возрастает
количество продукта реакции. В таком случае говорят о смещении химического
равновесия вправо, в сторону продукта.
Таким
образом, увеличение концентрации реагентов (жидких или газообразных) смещает в
сторону продуктов, т.е. в сторону прямой реакции. Увеличение концентрации
продуктов (жидких или газообразных) смещает равновесие в сторону реагентов,
т.е. в сторону обратной реакции.
Изменение
массы твердого вещества не изменяет положение равновесия.
2) Влияние температуры – увеличение температуры смещает равновесие в
сторону эндотермической реакции.
а)
N2 (Г) + 3H2 (Г) ↔ 2NH3 (Г) + 92,4 кДж (экзотермическая – выделение
тепла)
При
повышении температуры равновесие сместится в сторону реакции разложения аммиака
(←)
б)
N2 (Г) + O2 (Г) ↔ 2NO (Г) – 180,8 кДж (эндотермическая — поглощение тепла)
При
повышении температуры равновесие сместится в сторону реакции образования NO (→)
3) Влияние давления (только для газообразных
веществ) – при увеличении
давления, равновесие смещается в сторону образования
веществ, занимающих меньший объём.
N2 (Г) + 3H2 (Г) ↔ 2NH3 (Г)
1V — N2
3V — H2
2V
– NH3
При
повышении давления (P): до реакции 4V газообразных веществ → после реакции 2V
газообразных веществ, следовательно, равновесие смещается вправо (→)
При
увеличении давления, например, в 2
раза, объём газов уменьшается в такое же количество раз, а следовательно,
концентрации всех газообразных веществ возрастут в 2 раза. Kp = k1/k2 = [NH3]2/ [N2][H2]3
В этом случае числитель выражения для К
увеличится в 4 раза, а знаменатель в 16
раз, т.е. равенство нарушится. Для его восстановления должны возрасти
концентрация аммиака и
уменьшиться концентрации азота и водорода. Равновесие сместится вправо.
Итак, при повышении давления равновесие
смещается в сторону уменьшения объема, при понижении давления – в сторону
увеличения объёма.
Изменение давления
практически не сказывается на объёме твердых и жидких веществ, т.е. не изменяет
их концентрацию. Следовательно, равновесие реакций, в которых газы не
участвуют, практически не зависит от давления.
! На течение химической реакции влияют вещества – катализаторы.
Но при использовании катализатора понижается энергия активации как
прямой, так и обратной реакции на одну и ту же величину и поэтому равновесие не смещается.
Решите задачи:
№1. Исходные концентрации СO и O2 в обратимой реакции
2CO
(г) + O2
(г)↔ 2 CO2
(г)
Равны соответственно 6
и 4 моль/л. Вычислите константу равновесия, если концентрация CO2 в момент
равновесия равна 2 моль/л.
№2. Реакция протекает по уравнению
2SO2
(г) + O2 (г)
= 2SO3 (г) +
Q
Укажите, куда сместится равновесие, если
а) увеличить давление
б) повысить температуру
в) увеличить концентрацию кислорода
г) введение катализатора?
Видео «Химическое равновесие в растворах»
Решение задачи по теме «Химическое равновесие»
Источник

