Артериальная гипертония ремоделирование миокарда
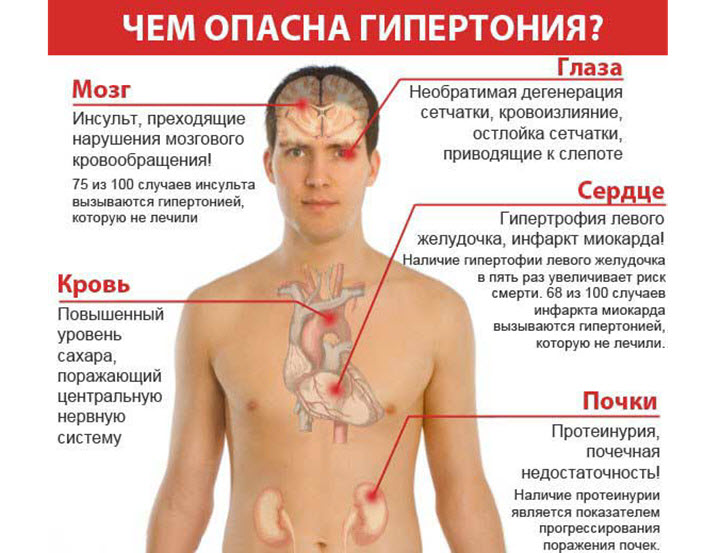
Согласно результатам эпидемиологических исследований последних лет, повышенное артериальное давление (АД) ассоциируется с развитием ХСН не менее чем в 80 % случаев. Артериальная гипертония (АГ) широко распространена в популяции большинства стран мира. Длительное, порой латентное, течение АГ характеризуется формированием ремоделирования миокарда левого желудочка (ЛЖ) сердца. Известно, что миокард представлен двумя компонентами – кардиомиоциты и соединительнотканный матрикс. В физиологических условиях в средней оболочке сердца соотношение кардиомиоцитов и соединительнотканного компонента колеблется от 3:1 до 4:1, что обеспечивает выполнение сократительной функции [3]. Предиктором прогрессирования и осложненного течения АГ является трансформация миокарда – один из патогенетических компонентов регуляции гомеостаза в условиях хронического повышения АД, величина которого – важный фактор, определяющий тяжесть АГ, прогноз и тактику лечения больных. Структурно-функциональная модификация сердца на фоне старения организма обусловлена сочетанием миокардиального стресса вследствие увеличения пред- или постнагрузки, активации окислительного повреждения и нейрогуморальных сдвигов, вызывающих развитие компенсаторной гипертрофии и ремоделирования миокарда, предопределяя формирование его дисфункции [4]. Это способствует развитию интерстициального фиброза миокарда и повышению его жесткости. Гипертрофия левого желудочка (ГЛЖ) – наиболее распространенный вариант жестко-эластической трансформации миокарда, влияющий на прогноз больных АГ всех возрастных групп. Однако анатомические изменения ЛЖ при гипертонической болезни ограничиваются не только увеличением массы миокарда, но и изменением его геометрии [1,2]. Непропорциональный рост миокардиальных и соединительнотканных структур способствует нарушению сначала диастолической, а затем систолической функции левого желудочка и развитию застойной сердечной недостаточности. Миокардиальный фиброз приводит к уменьшению коронарного резерва, что у больных с артериальной гипертонией может наблюдаться и при интактных коронарных артериях. Нарушение миокардиальной перфузии происходит вследствие увеличения коронарного сосудистого сопротивления, уменьшения количества капилляров на грамм мышечной ткани, структурных изменений коронарных артерий, эндотелиальной дисфункции. Уменьшение коронарного резерва при ГЛЖ повышает чувствительность сердца к ишемии, когда увеличивается потребность миокарда в кислороде или снижается перфузионное давление. Наличием миокардиальной ишемии при гипертоническом сердце можно объяснить учащение случаев желудочковых аритмий, фибрилляции предсердий, инфарктов миокарда и внезапной коронарной смерти у больных АГ. Оценка распространенности разных вариантов сердечного ремоделирования больных артериальной гипертонией пожилого возраста, их связи с величиной артериального давления необходима для определения их прогностической значимости. Развитие и прогрессирование процесса фиброзирования в экстрацеллюлярном матриксе миокарда служит точкой невозврата, определяющей дальнейший неблагоприятный прогноз заболевания. В отличие от лабильных значений систолического (САД) и диастолического артериального давления (ДАД) показатель среднего гемодинамического артериального давления (СГАД) относительно постоянен и более точно отражает влияние постнагрузки на структурные изменения миокарда левого желудочка.
Цель исследования: определение сопряженности СГАД с выраженностью фиброза в миокарде левого желудочка у женщин старшего возраста с АГ.
Материалы и методы исследования
В исследовании приняли участие 125 женщин пожилого возраста (средний возраст – 67,4±2,3 года). Длительность заболевания у больных АГ составила 9,2±1,6 года. Все пациенты подписали информированное согласие на участие в исследовании. Диагноз гипертоническая болезнь и ее степень устанавливались на основании критериев их диагностики в соответствии с рекомендациями рабочей группы по диагностике и лечению артериальной гипертензии Европейского общества по артериальной гипертензии и Европейского общества кардиологов (2013). Основную группу составили 100 пациенток, страдающих АГ I-II степени, группу сравнения – 25 практически здоровых женщин аналогичного возраста. Критерии включения в исследование: наличие верифицированной артериальной гипертонии II cтадии. Критериями исключения из исследования служили вторичные гипертензии, сахарный диабет, заболеваниями щитовидной железы, внутренних органов в стадии обострения, системные заболевания соединительной ткани, анемии, злокачественные новообразования, тяжелые нарушения сердечного ритма. Всем пациентам выполнено определение уровня глюкоза крови натощак, в сравниваемых группах пациентов данный показатель находился в пределах нормы; проведено электрокардиографическое исследование; выполнялось 3–кратное измерение АД в соответствии с международными стандартами (на обеих руках сидя, лежа). СГАД вычисляли по формуле = (САД+2ДАД) /3. Показатель считался достаточном 85–95 мм.рт.ст. Исследование геометрии сердца проводили методом эхокардиографии (ЭхоКГ) с применением УЗ сканера MyLab15 (Esoate/PieMedical, Италия) в М и В-режимах по методике Американского общества по эхокардиографии. Определялись показатели: конечные систолический и диастолический размеры левого желудочка (КСР ЛЖ, КДР ЛЖ), конечные систолический и диастолический объемы левого желудочка (КСО ЛЖ, КДО ЛЖ), толщина межжелудочковой перегородки и толщина задней стенки левого желудочка (ТМЖП, ТЗСЛЖ), фракция выброса ЛЖ по Тейхольцу (ФВ). В нашем исследовании в сравниваемых группах пациентов данный показатель находился в пределах нормы. На основании указанных измерений рассчитывали следующие показатели: относительную ТМЖП (ОТМЖП): ОТМЖП = 2*ТМЖП/КДР; относительную ТЗСЛЖ (ОТЗСЛЖ): ОТЗСЛЖ = 2*ТЗСЛЖ/КДР; относительную толщину стенки ЛЖ (ОТС): ОТС = (ТМЖПд+ТЗСЛЖ)/КДР; индекс массы миокарда левого желудочка (ИММЛЖ) как отношение ММЛЖ к S, где S-площадь поверхности тела (ППТ), определяемая по формуле D. Dubois: (ППТ = 0,007184*масса тела *0,425*рост*0,725). Оценка типа ремоделирования левого желудочка (ЛЖ) проводилась по классификации A. Ganau et al., в модификации R. B. Devereux et al. [1992]. Концентрическое ремоделирование ЛЖ (КРЛЖ) устанавливали при повышении относительной толщины задней стенки ЛЖ и относительной толщины межжелудочковой перегородки ≥ 0,45 на фоне нормального индекса массы миокарда левого желудочка; концентрическую ГЛЖ (КГЛЖ) – при относительной толщине стенок ≥ 0,45 и повышенном ИММЛЖ, эксцентрическую ГЛЖ (ЭГЛЖ) – при ОТС
Введение
Ишемическая болезнь сердца (ИБС) и артериальная гипертензия (АГ) до сих пор являются ведущими проблемами здравоохранения не только Российской Федерации, но и большинства стран мира 4. Отмечено, что прогноз и качество жизни пациентов с ИБС и АГ в существенной степени зависят от возникших у них сердечно-сосудистых осложнений (ССО). Показано, что у большинства обследованных больных частота развития ССО ассоциируется с нарушением функции, структуры и геометрии левого желудочка (ЛЖ) 5. Можно полагать, что вопросы анализа функционального состояния миокарда, риска развития ССО, корреляций параметров ремоделированияи сократительной функции ЛЖ у мужчин и женщин с ИБС и АГ нуждаются в более детальном освещении [1, 2, 5, 9, 10].
Цель исследования. Изучить показатели функционального состояния миокарда, риск развития сердечно-сосудистых осложнений, корреляций параметров ремоделирования и сократительной функции левого желудочка у мужчин и женщин с ишемической болезнью сердца и артериальной гипертензией.
Полученные результаты. Сравнительная характеристика показателей функционального состояния миокарда у мужчин с ИБС и АГ, имеющих различные варианты ремоделирования ЛЖ, представлена в табл. 1.
Сравнительная характеристика показателей функционального состояния миокарда у мужчин с ИБС и АГ, имеющих различные варианты ремоделирования ЛЖ(M±SD)
Прогностическая значимость формы и геометрии ЛЖ у пациентов с артериальной гипертонией (АГ) продолжает дискутироваться. В более ранних исследованиях ремоделирование ЛЖ рассматривалось как адаптивный ответ на перегрузку давлением и объемом, и это связывалось с более благоприятным прогнозом. На самом деле процесс адаптации ЛЖ к гипертензии является более сложным, чем ожидалось. Сердце способно адаптироваться к длительной АГ развитием концентрической гипертрофии ЛЖ. В соответствие с образцом компенсаторного ответа толщина стенки ЛЖ увеличивается пропорционально уровню А/Д для поддержания нормального миокардиального стресса. Очевидно, что спектр адаптации сердца к гипертензии должен быть связан с разницей в гемодинамической нагрузке и с состоянием сократимости миокарда. Дилатация ЛЖ представляет собой поздний переход от гипертрофии ЛЖ к его миокардиальной недостаточности.
Широкое использование ЭХО-КГ метода позволило классифицировать архитектонику ЛЖ у пациентов с АГ на четыре геометрические модели на базе таких показателей, как масса миокарда и относительная толщина стенки ЛЖ. Индекс относительной толщины стенки ЛЖ представляет собой чувствительный индикатор геометрической модели при гипертрофии и определяется отношением толщины стенки ЛЖ к поперечному диаметру его полости в конце диастолы. Этими геометрическими моделями являются:
1) концентрическая гипертрофия (увеличение массы миокарда и
относительной толщины стенки ЛЖ);
2) эксцентрическая гипертрофия (увеличение массы при нор-
мальной относительной толщине);
3) концентрическое ремоделирование (нормальная масса и уве-
личенная относительная толщина стенки);
4) нормальная геометрия ЛЖ;
А. Ганау и соавт. определили гемодинамические особенности и состояние сократимости ЛЖ у 165 пациентов с АГ в зависимости от его геометрической модели. Результаты этого анализа оказались неожиданными и не совпадают с представлениями большинства практикующих кардиологов. Концентрическая гипертрофия ЛЖ наблюдалась только у 8% исследуемых; 27% имели эксцентрическую гипертрофию; 13% — концентрическое ремоделирование ЛЖ; 52% исследуемых характеризовались нормальной геометрией ЛЖ. Форма ЛЖ была наиболее эллипсоидной в группе пациентов с концентрической гипертрофией и наиболее сферической в группе с эксцентрической гипертрофией.
Различия в структурно-геометрической модели ЛЖ у пациентов с АГ тесно связаны с патофизиологией сердца и кровообращения. Пациенты с концентрической гипертрофией характеризуются почти нормальным конечным систолическим миокардиальным стрессом, нормальными размерами и формой ЛЖ, повышенным общим периферическим сосудистым сопротивлением (ПСС) и небольшим увеличением сердечного индекса.
Для пациентов с концентрическим ремоделированием также характерны нормальный уровень конечного систолического миокардиального стресса и повышение общего периферического сопротивления. Вместе с тем они отличаются сниженными ударным и сердечным индексами. Стимул к увеличению относительной толщины стенки ЛЖ в этой группе не до конца понятен. Отчасти он может быть объяснен уменьшением податливости артерий, на что указывает субнормальный ударный объем при небольшом повышении уровня пульсового А/Д. Пациенты с эксцентрической гипертрофией ЛЖ х-ся высоким сердечным индексом, нормальным ПСС, увеличением полости ЛЖ, конечного систолического миокардиального стресса, указывающими на неадекватность гипертрофии ЛЖ. В качестве гемодинамических предпосылок к формированию данной геометрической модели приводится преимущественное увеличение венозного тонуса или ОЦК. Абсолютное большинство с АГ имеют нормальную геометрию ЛЖ и характеризуются небольшим увеличением общего ПСС, систолического и диастолического А/Д.
Даже небольшое изменение массы ЛЖ в пределах нормальных значений может служить прогностическим признаком повышенного риска сердечно-сосудистых осложнений. Многочисленные исследования показывают, что увеличение массы ЛЖ является более строгим предиктором сердечно-сосудистых осложнений и смертности, чем уровень А/Д и другие факторы риска, за исключением возраста. Эти данные согласуются с результатами других исследований и поддерживают концепцию, согласно которой увеличение массы ЛЖ является общим финальным путем многих неблагоприятных сердечно-сосудистых исходов.
Конфигурация ЛЖ независимо от массы миокарда оказывает влияние на прогноз пациентов с АГ. В одном из исследований была изучена разница в сердечно-сосудистом риске у 694 пациентов, страдающих АГ, с нормальной массой миокарда ЛЖ, у которых при проведении исходной ЭХО-КГ обнаруживались либо нормальная конфигурация ЛЖ, либо его концентрическое ремоделирование. Длительность наблюдения 8 лет (в среднем 3 года). Случаи сердечно-сосудистых осложнений, включая фатальные составили 2.39 и 1.12 на 100 пациентов в год в группах с концентрическим ремоделированием и без него соответственно (в 2.13 раза).
Наблюдение за 253 пациентами с изначально не осложненной эссенциальной гипертонией в течение 10 лет, проведенное М.Корен и соавт., подтвердило, что частота сердечно-сосудистых осложнений и смертность достаточно строго зависят от геометрической модели ЛЖ. Так наихудший прогноз по сердечно-сосудистым осложнениям (31%) и смертности (21%) был отмечен в группе пациентов с концентрической гипертрофией ЛЖ. Наиболее благоприятный прогноз (отсутствие летальных исходов и 11% сердечно-сосудистых осложнений) бал характерным для группы пациентов с нормальной геометрией ЛЖ.
Пациенты с эксцентрической гипертрофией и концентрическим ремоделированием занимали промежуточное положение. Изучение патофизиологии и патогенеза изменения структуры и геометрии ЛЖ у пациентов с АГ позволяет заключить, что при концентрическом ремоделировании имеет место «недогрузка объемом», возможно из-за «натрийуреза от давления». В ответ на недогрузку объемом не происходит явной гипертрофии ЛЖ. Изучение механизмов недогрузки ЛЖ может предоставить новые стратегии для предупреждения прогрессирования гипертензивного поражения сердца и оптимизации гипотензивного лечения.
Источник
Артериальная гипертензия (АГ) является главным фактором риска сердечно-сосудистой заболеваемости и смертности. Наличие АГ повышает риск развития ишемической болезни сердца (в том числе острого инфаркта миокарда и внезапной коронарной смерти) более чем в 2 раза, а возникновения сердечной недостаточности и инсульта — более чем в 3 раза.
В последние годы внимание специалистов, исследующих эссенциальную АГ, обращено на ремоделирование сердечно-сосудистой системы при данном заболевании. Ремоделирование сердца представляет собой процесс комплексного нарушения его структуры и функции и включает увеличение массы миокарда, дилатацию полостей и изменение геометрической характеристики желудочков.
Исследования последних лет показали, что гипертрофия левого желудочка (ГЛЖ) является далеко не единственным вариантом развития гипертонического сердца. С совершенствованием эхокардиографической диагностики ГЛЖ и более углубленным изучением данной проблемы стало очевидно, что анатомические изменения левого желудочка при АГ не всегда сопровождаются нарастанием массы миокарда. Оказалось, что во многих случаях изменение геометрии левого желудочка, в частности уменьшение размеров его полости, происходит при нормальной массе миокарда.
Природа ремоделирования при эссенциальной АГ неоднородна; с одной стороны — это ответ на повреждающую перегрузку, с другой стороны, доказано, что ремоделирование — процесс, связанный с первичным и нейрогуморально опосредованным нарушением клеточного ионотранспорта. Среди гуморальных нарушений, участвующих в процессах ремоделирования, главная роль отводится патологической активации ренинангиотензиновой системы (РАС), симпатоадреналовой системы и гиперинсулинемии.
Морфологические изменения при АГ характеризуются постепенным изменением геометрии и массы миокарда. В процесс сердечного ремоделирования вовлекаются все виды клеток, присутствующие в миокарде: миоциты, интерстициальные клетки, сосудистый эндотелий и иммунные клетки. На ранних этапах патологической ГЛЖ увеличивается диаметр кардиомиоцитов, число миофибрилл и митохондрий и размеры ядер. В более поздних стадиях гипертрофии отмечают также некоторые изменения клеточной организации и формы кардиомиоцитов. Последняя фаза гипертрофии характеризуется утратой сократительных элементов и параллельного расположения саркомеров в кардиомиоцитах. Другой важный морфологический признак гипертонического сердца — увеличение содержания в миокарде коллагена и фиброзной ткани. Такие факторы, как ангиотензин II, эндотелин-1 и альдостерон, обладают эффектом пролиферации фибробластов. Происходит также ремоделирование коронарных резистивных сосудов с последующим развитием периваскулярного фиброза в интрамуральных коронарных артериях и артериолах вместе с утолщением их срединного слоя. Помимо контрактильных нарушений в кардиомиоцитах, интерстициального и периваскулярного фиброзов, гибель кардиомиоцитов (апоптоз) теперь рассматривают как один из возможных определяющих факторов, способствующих переходу от компенсированной стадии ГЛЖ к декомпенсированной.
Непропорциональный рост миокардиальных и соединительнотканных структур способствует нарушению сначала диастолической, а затем и систолической функции левого желудочка и развитию застойной сердечной недостаточности. Миокардиальный фиброз приводит к уменьшению коронарного резерва, что у больных АГ может наблюдаться и при интактных коронарных артериях. Нарушение миокардиальной перфузии происходит вследствие увеличения коронарного сосудистого сопротивления, уменьшения количества капилляров на грамм мышечной ткани, структурных изменений коронарных артерий, эндотелиальной дисфункции. Уменьшение коронарного резерва при ГЛЖ повышает чувствительность сердца к ишемии, когда увеличивается потребность миокарда в кислороде или снижается перфузионное давление. Наличием миокардиальной ишемии при гипертоническом сердце можно объяснить учащение случаев желудочковых аритмий, фибрилляции предсердий, инфарктов миокарда и внезапной коронарной смерти у больных АГ.
Наиболее распространенной классификацией типов ремоделирования левого желудочка при АГ является классификация A. Ganau (1992), которая основана на определении индекса массы миокарда левого желудочка (ИММЛЖ) и относительной толщины стенок (ОТС) этого желудочка. В зависимости от уровня ИММЛЖ и ОТС выделяют четыре различных типа геометрической адаптации левого желудочка к гипертензии:
1) концентрическая гипертрофия левого желудочка (увеличение ИММЛЖ и ОТС);
2) эксцентрическая гипертрофия (увеличение ИММЛЖ при нормальной ОТС);
3) концентрическое ремоделирование (увеличение ОТС при нормальном ИММЛЖ);
4) нормальная геометрия левого желудочка.
По наблюдениям A. Ganau и R. Devereux при обследовании 165 нелеченых больных, сравнимых по тяжести и длительности гипертонии, у 52% был выявлен нормальный тип геометрии ЛЖ, у 13% — концентрическое ремоделирование, у 27% — эксцентрическая ГЛЖ и лишь у 8% — концентрическая ГЛЖ. Частота обнаружения разных типов ремоделирования левого желудочка при АГ различной степени тяжести изучена недостаточно. По данным Е. Шляхто (1999), концентрические варианты ремоделирования чаще встречаются при умеренной АГ, чем при мягкой, в то время как нормальный тип геометрии и эксцентрическая ГЛЖ — при I стадии артериальной гипертонии (по классификации ВОЗ, 1993).
От типа ремоделирования левого желудочка при АГ зависит риск развития сердечно-сосудистых осложнений. Наименее благоприятной в плане прогноза является концентрическая ГЛЖ — вероятность возникновения сердечно-сосудистых заболеваний в течение 10 лет составляет 30%; далее следует эксцентрическая ГЛЖ — 25%; концентрическое ремоделирование — 25%; нормальный тип геометрии — 9%. Некоторые авторы связывают это с тем, что наибольшая масса левого желудочка наблюдается при концентрической ГЛЖ, следовательно, неблагоприятный прогноз обусловлен увеличением массы миокарда левого желудочка (ММЛЖ).
Известно, что наличие ГЛЖ, независимо от уровня артериального давления, является неблагоприятным прогностическим признаком. Фремингемское исследование показало, что у лиц от 35 до 64 лет с электрокардиографическими признаками ГЛЖ риск развития сердечно-сосудистых заболеваний в 3-6 раз выше, чем у лиц без ГЛЖ. Установлено, что увеличение ИММЛЖ на 50 г/м2 сопровождается повышением риска ишемической болезни сердца на 50%. Относительный риск смерти при увеличении ММЛЖ на 100 г возрастает в 2,1 раза, а при увеличении толщины задней стенки левого желудочка на 0,1 см — приблизительно в 7 раз.
По данным эхокардиографии (ЭхоКГ) наличие гипертрофии стенок левого желудочка регистрируют, если толщина межжелудочковой перегородки и/или задней стенки левого желудочка в конце диастолы превышает 1,1 см. Более точным признаком ГЛЖ является увеличенная ММЛЖ, которая рассчитывается по формуле R. Devereux и N. Reichek (1977):
ММЛЖ = 1,04 ([КДР + ТЗСЛЖ + ТМЖП]3 − [КДР]3) − 13,6,
где КДР — конечный диастолический размер, ТЗСЛЖ — толщина задней стенки левого желудочка, ТМЖП — толщина межжелудочковой перегородки, выраженные в сантиметрах.
Поскольку ММЛЖ в значительной степени зависит от пола, роста и массы тела, ее значение индексируют по отношению к площади поверхности тела. В настоящее время отсутствуют общепризнанные нормальные значения ИММЛЖ. По данным литературы, чаще пользуются ЭхоКГ-критериями гипертрофии, предложенными R. Devereux (1984): ИММЛЖ у мужчин — более 134 г/м2, у женщин — более 110 г/м2. Однако в последние годы наметилась тенденция к использованию более низких значений ММЛЖ в качестве критерия его гипертрофии.
Концентрическая ГЛЖ, как правило, ассоциируется с высоким артериальным давлением, в то время как эксцентрическая ГЛЖ обычно связана с ожирением и увеличением объема циркулирующей крови.
При концентрической ГЛЖ повышение артериального давления обусловлено в основном ростом общего периферического сопротивления (ОПС) при незначительно увеличенном или нормальном сердечном выбросе. Концентрическая ГЛЖ развивается вначале как адаптивный процесс с целью уменьшения возросшего напряжения на стенки левого желудочка. Рост постнагрузки приводит к увеличению параллельных рядов саркомеров, происходит утолщение стенок и увеличение массы миокарда левого желудочка.
У больных АГ с эксцентрической ГЛЖ увеличен сердечный выброс с минимально повышенным или нормальным ОПС. Увеличение преднагрузки повышает диастолическое напряжение стенок левого желудочка, удлиняются саркомерные ряды кардиомиоцитов, расширяется полость и меняется форма (сферическая) левого желудочка.
Пациенты с концентрическим типом ремоделирования левого желудочка имеют относительно мягкую гипертензию с повышенным ОПС и сниженным сердечным выбросом. Для больных АГ с нормальным типом геометрии левого желудочка характерны невысокие значения показателей артериального давления; ОПС и/или сердечный выброс увеличены незначительно.
Помимо анатомических особенностей, функциональные изменения миокарда, в частности нарушение диастолической функции левого желудочка, также являются отражением процесса ремоделирования. ГЛЖ в настоящее время рассматривается как одна из важнейших причин нарушений расслабления левого желудочка. Признаки нарушения расслабления миокарда могут наблюдаться у больных с АГ и без ГЛЖ и зачастую обнаруживаются раньше, чем увеличение мышечной массы миокарда. Вероятно, это связано с опережающим развитием фиброза миокарда, являющегося важным фактором, ведущим к нарушению процесса расслабления миокарда. Исследования М. Lin и соавт. (1995) при сравнительной оценке структуры и функции левого желудочка у пациентов с АГ продемонстрировали значительное снижение диастолической функции левого желудочка, особенно в группе больных АГ с концентрической и эксцентрической ГЛЖ. Систолическая дисфункция отмечалась только при эксцентрической ГЛЖ.
=================
Вы читаете тему:
Типы ремоделирования миокарда левого желудочка при артериальной гипертензии и возможности медикаментозной коррекции
1. Типы ремоделирования миокарда левого желудочка при артериальной гипертензии.
2. Возможности медикаментозной коррекции на ремоделирование миокарда левого желудочка.
Павлова О. С., Нечесова Т. А. РНПЦ «Кардиология».
Опубликовано: «Медицинская панорама» № 6, сентябрь 2002.
Источник