Артериальная гипертония фактор риска инфаркта миокарда
В большинстве случаев артериальная гипертензия и инфаркт миокарда тесно взаимосвязаны. Оба заболевания поражают сердечно-сосудистую систему. Гипертония в стадии декомпенсации приводит к тяжелым осложнениям, отражающимся на состоянии мозга, сердца и почек. Это обусловлено патофизиологией гемодинамики. Предынфарктное состояние является прямым последствием стойкого повышения АД. Диагностика сердечно-сосудистых патологий проводится с помощью лабораторных и инструментальных методов. Лечение обязательно включает прием гипотензивных препаратов и пожизненный контроль цифр артериального давления.

Артериальная гипертензия и инфаркт миокарда: основная взаимосвязь
При высоком АД меняется гемодинамика. Нагрузка на сердце повышается, оно начинает работать на износ. При этом страдают коронарные сосуды, кровоснабжающие сердечную мышцу. Когда на фоне гипертонии развивается атеросклероз, а бляшки закупоривают сосудистый просвет, количество крови, проходящее через него, снижается. Развивается кислородное голодание миокарда. Если ишемия длительная или перекрыто кровоснабжение большого участка сердечной мышцы, возникает инфаркт.
Инфарктное состояние является крайней степенью ишемической болезни, возникающей на фоне артериальной гипертонии. При нем происходит некроз участка миокарда.
Вернуться к оглавлению
Причины инфаркта при гипертензии
К ним относятся:
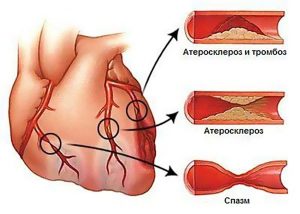 Спазм сосудов, атеросклероз, тромбоз часто приводят к серьезной патологии.
Спазм сосудов, атеросклероз, тромбоз часто приводят к серьезной патологии.
- Нарушение реологии крови. Когда на фоне высоких цифр систолического и диастолического артериального давления меняется гемодинамика, возникает недостаток кровоснабжения сердечной мышцы.
- Ишемия. При дефиците кровоснабжения миокарда через коронарные сосуды возникает его кислородное голодание.
- Атеросклероз. Образование атеросклеротических бляшек в сосудистом русле всегда сопровождает гипертонию.
- Рефлекторные спазмы. Высокое давление приводит к спазмированию сосудов, уменьшению их просвета и резкому нарушению кровоснабжения сердца.
Вернуться к оглавлению
Механизм развития
При гипертонии наблюдаются изменения во всех органах и системах. Она затрагивает головной мозг, кровеносное русло, почки и сердце. Сердечная мышца, выполняя функцию насоса, вынуждена с удвоенной силой нагнетать кровь в большой и малый круги кровообращения. Орган постепенно изнашивается. К этому добавляется, развившаяся на фоне гипертензии, коронарная недостаточность. Хроническая ишемия и постоянные скачки давления приводят к острому нарушению кровоснабжение миокарда и развитию его некроза. Этим термином медики обозначают отмирание определенного участка сердечной мышцы с выпадением ее функции.
Вернуться к оглавлению
Симптомы коронарного синдрома
Для инфаркта характерна такая клиническая симптоматика:
 Клиническим симптомом при патологическом состоянии является повышенное выделение липкого, холодного пота.
Клиническим симптомом при патологическом состоянии является повышенное выделение липкого, холодного пота.
- Внезапная боль за грудиной. Она похожа на стенокардию и иррадирует в шею, спину, правую или левую руку и челюсть. Болезненные ощущения носят приступообразный характер.
- Гипергидроз. У пациента появляется повышенная потливость. Пот холодный, липкий.
- Страх смерти. Это естественная реакция на нарушение гемодинамики, когда мозг недополучает достаточное количество кислорода, человек впадает в панику.
- Отсутствие купирования симптомов при приеме «Нитроглицерина».
- Специфическая поза. Пациент пытается сесть, опираясь на руки, и немного наклоняет туловище вперед. Так ему легче дышать.
- Синюшность кончиков пальцев и носогубного треугольника. При нарушениях кровообращения возникает цианоз этих участков.
- Потеря сознания. Если некрозом охвачен обширный участок сердечной мышцы, человек способен впадать в беспамятство.
Вернуться к оглавлению
Диагностические мероприятия
Для диагностики болезни проводятся такие лабораторные и инструментальные методики обследования:
- Общий анализ крови. Его данные показывают повышение количества лейкоцитов и скорости оседания эритроцитов.
- Биохимия крови. На анализе отмечается повышение трансаминаз, а именно аланинаминотрансферазы и аспартатаминотрансферазы. Рост концентрации ферментов свидетельствует о некрозе.
- Определение уровня креатинфосфокиназы. Этот специфический анализ является «золотым стандартом» при инфарктах.
- Электрокардиография. На электрокардиограмме при положительном диагнозе будут отмечаться специфические комплексы со смещением сегмента ST.
- Эхокардиография. На экране видно нарушение деятельности сердца, отображенное в ультразвуковом режиме.
- Тонометрия. При ней отмечаются сниженные цифры систолического и диастолического артериального давления вследствие недостаточной насосной функции миокарда.
Вернуться к оглавлению
Лечение патологии и дальнейшее ведение пациентов
С лечебной целью применяется медикаментозная терапия и коррекция образа жизни больных, перенесших инфаркт. Им рекомендуется прием антикоагулянтов, антиагрегантов и тромболитиков. Эти препараты уничтожают образовавшиеся в коронарных сосудах тромбы и предотвращают формирование новых. Пациенту выписывают диуретики. Эти мочегонные лекарства помогают выводить из организма лишнюю воду, чем снижают нагрузку на сердце. В схему лечения обязательно включают гипотензивные препараты. Среди них предпочтение отдают комбинированным формам бета-адреноблокаторов, ингибиторов ангиотензинпревращающего фермента и блокаторам кальциевых каналов. Рекомендации по изменению образа жизни включают диетическое питание и умеренную физическую активность.
Источник
Инфаркт миокарда – самое тяжелое проявление ишемической болезни сердца, развивающееся на фоне атеросклероза.
Инфаркт миокарда – некроз сердечной мышцы, развивающийся из-за прекращения кровотока в коронарной артерии вследствие ее тромбоза или эмболии, реже – в результате длительного спазма.
Миокард – это сердечная мышца. Кровоток в ней обеспечивается венечной (коронарной) артерией – три ее основных ветви (правая, левая передняя и левая задняя). Атеросклероз, как системный процесс, не обходит своим вниманием коронарную артерию. Образование склеротических бляшек в просвете венечных артерий препятствует нормальному кровотоку и снабжению миокарда кислородом.Либо какую-нибудь из них закупоривает кровяной сгусток – тромб, то участок сердца, который она питает, также остается без кровоснабжения, а значит, без кислорода. На голодном пайке клетки миокарда могут прожить лишь 20–30 минут, потом они гибнут, и возникает инфаркт – участок омертвения сердечной ткани (некроз). На пострадавшем месте остается рубец.
Причины инфаркта миокарда
Непосредственной причиной инфаркта миокарда является остро возникшее, внезапное прекращение кровотока в системе коронарной артерии, в одной или нескольких ее ветвях. Закупорка ветви коронарной артерии может быть вызвана ее тромбозом, реже эмболией или длительным (более получаса) стойким спазмом коронарной артерии.
Инфаркт миокарда является одним из проявлений ишемической болезни сердца. Поражение коронарной артерии в результате атеросклероза приводит к образованию на стенке сосуда склеротической бляшки и ее увеличению. Атеросклеротическая бляшка перекрывает просвет коронарной артерии, вызывая прогрессирующую ишемию соответствующего участка миокарда. Таким образом создаются условия для тромбоза и тромбоэмболии, полного прекращения кровотока в пораженной артерии и некроза (инфаркта) миокарда.
Факторы риска инфаркта миокарда
Наличие хотя бы одного из факторов риска реально увеличивает вероятность знакомства с инфарктом миокарда, причем присоединение каждого нового фактора риска повышает ее в геометрической прогрессии.
Факторы риска при инфаркте миокарда можно разделить на три категории:
Устранение факторов достоверно уменьшает риск развития инфаркта миокарда:
- курение;
- гиперхолестеринемия с высоким уровнем липопротеинов низкой плотности;
- артериальная гипертония.
Коррекция факторов с большой вероятностью снижает риск развития инфаркта миокарда:
- сахарный диабет;
- высокий уровень глюкозы в крови;
- низкая физическая активность (гиподинамия);
- избыточная масса тела.
Факторы не могут быть устранены или влияние на них не приводит к снижению риска развития инфаркта:
- пол (мужчины более подвержены развитию ИБС);
- возраст (учащение и отягощение заболеваний сердца с возрастом);
- наследственность (наличие болезней сердца у родственников).
Симптомы инфаркта миокарда
Основной симптом острого инфаркта миокарда – сильная боль в области сердца, обычно за грудиной. Инфарктная боль в состоянии покоя давит, жжет, может отдавать в руку, плечо, спину, челюсть, шею. При стенокардии подобная боль возникает во время нагрузки, а при инфаркте она начинается в покое и не проходит после принятых одна за другой трех таблеток нитроглицерина (по 1 таблетке под язык через каждые 5 минут). При наличии этих признаков следует немедленно вызвать скорую помощь. Умение терпеть в данном случае – опасный враг. Боль может быть настолько сильной, что вызывает кардиогенный шок с резким падением артериального давления и потерей сознания.
Иногда заболевание проявляет себя рвотой или неприятными ощущениями в желудке, перебоями в сердце или затруднением дыхания, потерей сознания. Случается, что инфаркт проходит незаметно. Человек перенес болезнь, даже не зная об этом. Так называемая безболевая форма инфаркта миокарда чаще встречается у людей, страдающих сахарным диабетом.
Развитие инфаркта миокарда может вызвать и другие симптомы:
- нарушения сердечного ритма;
- одышка с частым поверхностным дыханием;
- слабый пульс;
- слабость;
- потливость;
- бледность кожных покровов;
- тошнота;
- резкое повышение артериального давления с последующим его снижением.
Осложнения инфаркта миокарда
По времени развития осложнений инфаркта миокарда различают ранние (в первые часы) и поздние осложнения (развивающиеся через две недели).
- нарушение ритма и проводимости;
- нарушение насосной функции сердца (острая лево-, правожелудочковая недостаточность, аневризма, расширение зоны инфаркта);
- другие осложнения (эпистенокардический перикардит, тромбоэмболии, ранняя постинфарктная стенокардия, синдром Дресслера).
Прогноз
Пациенты с инфарктом миокарда требуют к себе самого серьезного отношения в связи с тяжелым прогнозом этого заболевания. Около трети инфарктов заканчиваются смертью пациентов еще до госпитализации в течение первого часа с момента появления симптомов. Смертность в течение первых четырех недель составляет от 13 до 28%, до 10% больных умирают в течение первого года после инфаркта.
В зависимости от степени поражения миокарда инфаркт разделяют на крупноочаговый, при котором некроз распространяется на всю толщину сердечной мышцы, и мелкоочаговый. Более опасен крупноочаговый инфаркт передней стенки миокарда. При инфаркте задней или боковой стенки последствия не столь тяжелы. Рубец на сердечной мышце остается на всю жизнь. Рассосаться он не может, и о перенесенном инфаркте сердце помнит всегда.
Восстановление кровотока в коронарных артериях в ранние сроки (в первые сутки развития инфаркта) делают прогноз более благоприятным. Прогноз исхода инфаркта зависит от распространенности поражения миокарда, тяжести его течения, возраста больного, развития у него осложнений. Но в любом случае на прогноз заболевания влияет своевременность начала лечения и адекватность проводимой терапии.
Диагностика инфаркта миокарда
При первых признаках инфаркта миокарда и даже всего лишь при подозрении на его развитие следует вызвать скорую помощь, обеспечить больному покой, лежачее положение и прием нитроглицерина.
Изменения, происходящие при инфаркте, хорошо видны на электрокардиограмме.
Анализы:
- общий анализ крови;
- биохимический анализ крови (определение признаков воспаления и повреждения – кардиотропных белков);
- анализ крови на холестерин крови;
- липидный профиль;
- анализ крови на сахар;
- коагулограмма (оценка состояния свертывающей системы крови).
Биохимические показатели при инфаркте миокарда определяются многократно для оценки динамики их состояния.
Инструментальные исследования:
- электрокардиография (ЭКГ)
- УЗИ сердца (Эхо-КГ);
- коронарография, которая часто проводится одновременно с внутрисосудистым тромболизисом (разрушение внутрисосудистого тромба).
При выписке из стационара больному проводится велоэргометрия или тредмил-тест для определения функционального состояния миокарда.
Лечение и реабилитация при инфаркте миокарда
Для того чтобы не рисковать, при малейшем подозрении на инфаркт врачи отправляют человека в реанимационное отделение больницы. И чем быстрее, тем лучше. Ведь только в течение первых нескольких часов, вводя специальные препараты, можно растворить свежий тромб и восстановить кровоток в коронарной артерии. Затем следует позаботиться о предотвращении образования новых тромбов. Для этого используют лекарства, замедляющие свертывание крови. Одно из самых надежных средств – ацетилсалициловая кислота, т. е. обычный аспирин. Он уменьшает частоту осложнений и продлевает жизнь людям, перенесшим инфаркт. Часто для лечения применяют бета-адреноблокаторы. Эти препараты сокращают потребность миокарда в кислороде, а значит, спасают клетки сердечной мышцы от гибели, уменьшают размеры некроза. Одновременно они делают работу сердца более экономной, что при инфаркте очень важно. При неэффективности лекарственной терапии используют так называемые инвазивные методы, в частности коронарную баллонную ангиопластику.
В первые дни заболевания обязателен строгий постельный режим. В это время поврежденное сердце может не выдержать даже минимальной нагрузки. Раньше человек, перенесший инфаркт, не поднимался с кровати несколько недель. Сегодня срок постельного режима значительно сокращен. Но все равно, хотя бы трое суток после инфаркта надо лежать в постели под присмотром врачей. Затем разрешается сидеть, позже вставать, ходить. Начинается выздоровление, адаптация к новой постинфарктной жизни.
Nota Bene!
Лечение инфаркта стволовыми клетками проходит этап активных исследований. Клинические испытания еще не проводились, однако в опытах на животных стволовые клетки оказывают положительный эффект. Специалисты считают, что терапия стволовыми клетками позволит существенно улучшить прогноз при остром инфаркте миокарда.
Профилактика инфаркта миокарда
- антитромботическая терапия аспирином или его аналогами снижает риск рецидива инфаркта миокарда;
- бета-блокаторы назначают пациентам, у которых имеется нарушение функции левого желудочка;
- терапия препаратами, снижающими уровень холестерина в крови (статины);
- прием полиненасыщенных жирных кислот;
- ингибиторы ангиотензин-превращающего фактора.
Интересный факт
Существует заблуждение, что после инфаркта следует максимально снизить физическую активность. При инфаркте миокарда ограничение физической активности необходимо в первые часы и дни с момента возникновения инфаркта, что позволяет снизить нагрузки на пораженный миокард. Однако ранняя активизация больного в сочетании с лечебной физкультурой значительно облегчают реабилитацию и снижают риск возможных осложнений. Отсутствие нагрузки повышает риск повторного инфаркта.
Эксперты: Баргер С. И., кандидат медицинских наук, кардиолог Давид Дундуа, кандидат медицинских наук, кардиолог
Подготовлено по материалам
- Иньков А. Н. ИБС. – Ростов н/Д: Феникс, 2000. – 96 с.
- Калинина А. Г., Поздняков Ю. М., Еганян Р. А. Стабильная стенокардия. – М.: ГЭОТАР-Медиа, 2010. – 176 с.
- Поллок М. Л., Шмидт Д. Х. Заболевания сердца и реабилитация. – Киев: Олимпийская литература, 2000. – 408 с.
- Фадеев П. А. Инфаркт миокарда. – М.: Оникс, 2007. – 128 с.
Источник
ММА имени И.М. Сеченова
Как известно, эссенциальная артериальная гипертензия (гипертоническая болезнь) ассоциируется со сложной картиной структурных изменений сердечно–сосудистой системы, что выражается в развитии гипертрофии левого желудочка и изменении его формы (ремоделирование), утолщении стенок крупных и мышечных артерий, ремоделировании небольших мышечных артерий (что приводит к увеличению отношения «стенка:просвет»), снижении количества и удлинении небольших артерий и артериол. Одни из них связаны с начальными стадиями развития эссенциальной артериальной гипертензии (АГ), другие являются адаптивной реакцией на возникшие изменения гемодинамики. Клиницистам давно известно, что у лиц, длительно страдающих АГ, с гораздо большей частотой (по сравнению с лицами, имеющими нормальные показатели АД) развиваются инфаркт миокарда, мозговой инсульт, изменения сосудов глазного дна и хроническая почечная недостаточнось. Эта закономерность хорошо демонстрируется предложенной в 1991 г. Dzau и Вraunwald схемой «сердечно–сосудистого континиума», представляющего из себя цепь связанных между собой событий, начиная от факторов риска (включающих и АГ) и заканчивающихся хронической сердечной недостаточностью. Эта цепь может быть прервана на любом этапе развитием инфаркта миокарда, мозгового инсульта, внезапной смертью (коронарной или аритмической). С позиций современных знаний движущим фактором, ведущим к поступательному движению в цепи сердечно–сосудистого континиума, следует, прежде всего, назвать широкий спектр расстройств нейро–гормональной регуляции. Имеется в виду нарушение баланса факторов так называемого прессорного звена (катехоламины, ангиотензин II, альдостерон, вазопрессин, система эндотелинов, фактор роста, аргинин–вазопрессин, система цитокинов, ингибитор активатора плазминогена) и депрессорного звена (система натрийуретических пептидов, простациклин, брадикинин, тканевой активатор плазминогена, монооксид азота, адреномедуллин), как на плазменном (циркулирующем) уровне, так и на тканевом. При этом если эффекты циркулирующих систем носят приспособительный и кратковременный характер, то тканевые системы вызывают хронические неблагоприятные и трудно устранимые последствия. Применительно к АГ следует также учитывать роль самого повышения АД, оказывающего гемодинамическую нагрузку на всю систему кровообращения. Так, данные исследования MRFIT, продемонстрировали четкую зависимость риска ишемической болезни сердца (ИБС) от уровня АД и позволили количественно оценить вклад в степень этого риска систолического (САД) и диастолического давления (ДАД). Независимо от степени повышения САД и ДАД наибольший риск был выше по сравнению с лицами, имевшими АД<120 и 80 мм рт.ст. При этом был отмечено большее значение САД. В известном Фрамингемском исследовании при повышении АД также был выявлен рост риска летальной ИБС, при этом подтвердилась более значимая роль САД для развития всех проявлений ИБС (стенокардия, инфаркт миокарда, внезапная смерть). Интересно отметить, что у мужчин с возрастом выявилась большая значимость САД, тогда как ДАД с возрастом обнаруживало тенденцию к снижению. Весьма интересны исследования отечественных авторов, проведенных в рамках проекта Липидных Исследовательских Клиник [2]. Исследования проводились в одном из районов гг. Москвы и Санкт–Петербурга. Проспективное наблюдение за смертностью осуществлялось в течение 19 лет у 7815 мужчин в возрасте 40–59 лет и в течение 14 лет у 3074 женщин в возрасте 30–69 лет При анализе относительного риска смертности от ИБС в зависимости от формы АГ оказалось, что относительный риск (ОР) смертности для лиц с изолированой диастолической АГ (ИДАГ) составил 1,2, при систолической АГ (ИСАГ) – 1,8, для систоло–диастолической АГ – 2,4 по сравнению с лицами, не имевшими повышенного АД.
В то же время масса миокарда левого желудочка (ММЛЖ) слабо коррелирует с однократно измеренным АД. Связь оказывается более тесной при проведении суточного мониторирования АД (СМАД). Так, средние величины суточного АД теснее коррелируют с ММЛЖ, а ночное снижение АД обнаруживает обратную корреляцию с ММЛЖ. Несомненно, гипертрофия левого желудочка (ГЛЖ) представляет сложную реакцию не только на АГ, но и на весь спектр перечисленных выше трофических факторов.
Наличие ГЛЖ у больных АГ ассоциируется с более высоким риском заболеваемости и смертности. В рамках Фрамингемского исследования показано, что наличие ГЛЖ сопряжено с пятикратным увеличением смертности в течение 5 лет наблюдения. В другом исследовании [6] наблюдалось 1893 пациентов, при эхокардиографическом исследовании у которых выявлена ГЛЖ. По истечении 6 лет наблюдения было отмечено, что при увеличении толщины задней стенки левого желудочка на 1 мм риск смертельных осложнений увеличивался в 7 раз.
В отношении мозгового инсульта большинство проспективных исследований также подтвердило большую роль САД. В исследовании MRFIT относительный риск развития инсульта составил 8,2 для САД и всего 4,4 – для ДАД. Данные отечественных авторов [3] указывают несколько меньшие величины: так, относительный риск для ИСАГ составил 3,2, при ИДАГ – 1,3, но при одновременном повышении САД и ДАД относительный риск возрастал до 4,1.
Поражение почек – третий по частоте поражения орган–мишень. В давние годы, когда отсутствовали эффективные антигипертензивные препараты, злокачественная и тяжелая АГ всего в течение 5 лет приводили к терминальной почечной недостаточности. Результаты MRFIT свидетельствуют о высокой непрерывной положительной связи между АГ и риском развития хронической почечной недостаточности (ХПН). В V докладе ОНК (1995) отмечен рост риска развития ХПН при возрастании степени повышения АД. При этом величина САД была более точным предиктором развития ХПН, нежели уровень ДАД. Однако хотя адекватное лечение АГ и снижало частоту ИБС и мозгового инсульта, существенного снижения частоты ХПН достигнуто не было [10].
Сочетание АГ с другим фактором риска – сахарным диабетом (СД) в еще большей степени увеличивает риск развития ХПН, как, впрочем, и ИБС, мозгового инсульта. Так, согласно результатам Фрамингемского исследования у больных СД в сочетании с АГ серьезные сердечно–сосудистые сложнения выявляют в 5 раз чаще, нежели в сопоставимых возрастных группах общей популяции [9].
Ни у кого не вызывает сомнения, что систематическое лечение АГ с эффективным контролем ее уровня является краеугольным камнем предотвращения «движения» по пути сердечно–сосудистого континуума.
Важность снижения АД известна врачам давно. Еще в достаточно раннем исследовании HDFP при 5–ти летнем наблюдении за 10940 больными (в возрасте 30–69 лет) с ДАД>90 мм рт.ст., получавшими «систематическое» лечение «старыми» препаратами по так называемой «ступенчатой» схеме (хлорталидон или триамтерен, резерпин или метилдопа, гидралазин, гуанетидин), было отмечено снижение смертности от всех сердечно–сосудистых заболеваний на 17% по сравнению с больными, леченными «обычным» методом. Повторное обследование спустя 12 лет показало, что ГЛЖ в группе «систематически» леченных была менее выраженной.
Ситуация в лечении АГ изменилась в значительно лучшую сторону с введением новых, более эффективных антигипертензивных препаратов и особенно ингибиторов ангиотензинпревращающего фермента (иАПФ). С полным основанием последнюю четверть 20 века можно назвать «эрой иАПФ». Дело в том, что эти препараты наряду с отчетливым антигипертензивным эффектом оказывают и выраженное органопротективное действие, связанное с воздействием на тканевые РААС различных органов. Суммируя многочисленные исследования, посвященные механизмам действия иАПФ, можно выделить несколько положений об их защитных свойствах в отношении сердечно–сосудистой системы [13]:
Кардиопротективные эффекты иАПФ
- восстановление баланса между потребностью и обеспечением миокарда О2;
- снижение пред– и постнагрузки левого желудочка;
- уменьшение объемов и массы левого желудочка;
- замедление (реверсия) ремоделирования левого желудочка;
- уменьшение симпатической стимуляции;
- антиаритмический эффект.
Вазопротективные эффекты иАПФ
- потенциально прямой антиатерогенный эффект;
- антипролиферативный и антимиграционный эффект в отношении гладкомышечных клеток, моноцитов, нейтрофилов;
- улучшение функции эндотелия;
- антитромбоцитарный эффект;
- усиление эндогенного фибринолиза;
- улучшение податливости артерий и их тонуса.
Нефропротективный эффект иАПФ связан со снижением внутриклубочковой гипертензии, увеличением скорости клубочковой фильтрации, уменьшением протеинурии, увеличением выделения натрия и снижением калийуреза, ростом общего диуреза [16]. В эксперименте дозы иАПФ, даже не являющиеся антигипертензивными, вызывают уменьшение внутриклубочкового матрикса, тормозят пролиферацию мезангиальных клеток и развитие склероза клубочков [15].
Многообразные органопротективные действия иАПФ дополняются также метаболическими эффектами: так чувствительность рецепторов к инсулину повышается, что ведет к усилению потребления глюкозы, синтез липопротеи дов высокой плотности увеличивается, тогда как синтез триглицеридов снижается и происходит усиленный распад липопротеидов очень низкой плотности.
Органопротективный эффект иАПФ у больных АГ подтвержден многочисленными исследованиями. Среди большого количества иАПФ следует обратить внимание на лизиноприл, обладающий весьма оригинальными свойствами. Лизиноприл – единственный гидрофильный ингибитор АПФ, не распределяющийся в жировой ткани, с продолжительностью действия 24–30 час. Эти свойства позволяют считать его препаратом выбора при лечении тучных пациентов с АГ. В этом плане большой интерес представляет многоцентровое двойное слепое рандомизированное плацебо–контролируемое исследование TROPHY, в котором сравнивалась эффективность 12–недельной терапии 232 больных с ожирением и АГ лизиноприлом и гидрохлортиазидом (под контролем суточного мониторирования АД). Больные с уровнем ДАД 90–109 мм рт.ст. были рандомизированы на лечение лизиноприлом 10, 20 или 40 мг 1 раз в день, гидрохлортиазидом 12,5, 25 или 50 мг. Средний показатель индекса массы тела статистически достоверно не различался в разных группах больных. Данные СМАД показали, что лизиноприл и гидрохлортиазид эффективно снижали АД на протяжении суток по сравнению с плацебо (р<0,001). Однако отличный эффект (нормализация АД) при лечении лизиноприлом достигался чаще, чем при использовании гидрохлортиазида, кроме того, лизиноприл лучше снижал ДАД, чем гидрохлортиазид. Отмечено также, что основная часть больных (57%), принимавших лизиноприл, оставались на дозе 10 мг в течение всего периода лечения, в то время как большинству больных, получавших гидрохлортиазид (71%) необходимо было увеличение дозы до 25–50 мг в сутки (так называемый «эффект ускользания»). У тучных больных особый интерес представляет уникальная фармакологическая особенность лизиноприла – гидрофильность. В отличие от других иАПФ лизиноприл не распределяется в жировой ткани, что позволяет создавать более высокие концентрации в крови, эндотелии сосудов и других органах и тканях. Применение лизиноприла особенно оправдано также у больных с различными нарушениями углеводного обмена, в том числе в рамках метаболического синдрома.
Ингибиторы АПФ весьма эффективны и в отношении обратного развития ГЛЖ. Так в исследовании SAMPLE [14] были включены 206 больных с АГ и ГЛЖ. Лечение лизиноприлом в дозе 20 мг/сут в сочетании с гидрохлортиазидом (12,5–25 мг/сут) и без него показало (наряду с эффективным снижением АД) и уменьшение индекса массы миокарда левого желудочка на 15,8%. В другом исследовании назначение в течение 12 мес лизиноприла в дозе 10 мг/сут больным после трансплантации почек выявило (наряду со снижением АД) у 46% больных снижение индекса массы миокарда левого желудочка не менее чем на 15% [8]. Лечение больных АГ лизиноприлом в течение 12 недель показало статистически достоверное уменьшение толщины межжелудочковой перегородки и задней стенки ЛЖ [7]. В другой работе лечение в течение 3 лет лизиноприлом больных АГ выявило статистически достоверное снижение индекса массы миокарда левого желудочка в концу 1 года, к концу же 3–го года это уменьшение статистически не отличалось от результатов, полученных в конце 1–го года лечения [17]. В этой же работе выявлено статистически достоверное снижение соотношения «медиа/просвет» и улучшение функции эндотелия, о чем свидетельствовала более выраженная реакция сосудов на введение ацетилхолина.
Наряду с регрессией ГЛЖ лизиноприл вызывает обратное развитие миокардиального фиброза – патологического процесса, ведущего неизбежно к значительному нарушению диастолической функции сердца. В проспективном рандомизированном двойном слепом исследовании в течение 6 месяцев сравнивалось действие лизиноприла и гидрохлортиазида у пациентов с АГ, ГЛЖ и дисфункцией левого желудочка [5]. На фоне лечения выявлено уменьшение объемной фракции коллагена на 8,7% (р<0,05 по сравнению с гидрохлортиазидом), а также объемной фракции маркера фиброза (гидроксипролина) в миокарда не 16,2% (р<0,0001 по сравнению с гидрохлортиазидом). Одновременно происходило улучшение диастолической функции сердца, что выражалось в увеличении соотношения пикового кровотока в период раннего наполнения левого желудочка и систолы левого предсердия (Е/А) с 0,72 до 0,91 (р<0,05 по сравнению с гидрохлортиазидом) и снижению времени изоволюмического расслабления с 123 мсек до 81 мсек (р<0,0002). Одновременно было выявлено и статистически достоверное уменьшение диаметра кардиомиоцитов. В другом исследовании 6–ти месячное лечение лизиноприлом больных АГ выявило нормализацию сывороточной концентрации PIIP (аминотерминального пептида проколлагена III типа), что коррелировало со скоростью раннего трансмитрального потока [12].
Несомненный интерес представляют исследования эффективности лизиноприла у больных АГ и диабетической нефропатией. На фоне лечения лизиноприлом в средней дозе 13,5 мг и контроле на 4,8,19 и 40 недели лечения, отмечено достоверное снижение альбуминурии с 49,7 до 25,9 мкг/мин и нормализация АД [4].
Лизиноприл вызывает также и замедление прогрессирования ретинопатии у больных инсулинзависимым сахарным диабетом. В исследовании EUCLID, включавшем 530 больных инсулинзависимым сахарным диабетом, 265 человек получали лизиноприл в дозе 10 мг (при необходмости – 20 мг/сут) в течение 24 месяцев. По окончании лечения у больных. получавших лизиноприл, общая экскреция альбумина была на 18% ниже; при исходной же микроальбуминурии снижение ее отмечалось на 49,7%. Лизиноприл снижал прогрессирование ретинопатии на две и более степени (р=0,05) и прогрессирование пролиферативной ретинопатии (р=0,03).
В рамках «движения» сердечно–сосудистого континиума несомненный интерес представляет взаимоотношение ИБС и ингибиторов АПФ.
Принципиально возможен антиишемической эффект иАПФ, механизм действия которого можно представить следующим образом:
- нормализация функции эндотелия и усиление эндотелийзависимой коронарной вазодилатации;
- новообразование капилляров в миокарде;
- стимуляция высвобождения оксида азота и простациклина;
- цитопротективный эффект, опосредуемый брадикинином через В2–рецепторы;
- уменьшение потребности миокарда в кислороде в результате обратного развития ГЛЖ у больных АГ;
- торможение миграции тромбоцитов и усиление фибринолитической активности крови.
В ряде исследований показан антиишемический эффект иАПФ. Так, еще в середине 80–х годов в работах Lai C. и Strozzi C. продемонстрировали антиишемический эффект каптоприла и эналаприла у больных стабильной стенокардией (и нормальным АД) [11,18]. Как указывает Opie L.H. в своей обстоятельной монографии, посященной иАПФ, результат лечения ИБС зависит от достаточно большого количества факторов, в том числе и от наличия АГ. Тем не менее в последние годы интерес к иАПФ, как препарату, возможно, полезному при стенокардии, появился вновь. Так, показано, что через 12 месяцев лечения эналаприлом суммарное количество эпизодов ишемии (использовалось Холтеровское мониторирование) у больных, перенесших инфаркт миокарда, уменьшилось на 61% (по сравнению с традиционной терапией антиангинальными препаратами с гемодинамическим механизмом действия) [1].
В настоящее время антиишемический эффект иАПФ во многом связывается с антиатеросклеротическим действием этих препаратов. Снижение активности ангиотензина–II (посредством назначения иАПФ) ведет к замедлению (блокаде?) таких процессов, как нейрогормональная и цитокиновая активация, воздействию на воспалительные процессы, оксидативный стресс, продукции индуцибельной NO–синтетазе, апоптоз и фибринолитический дисбаланс. В настоящее время проводится несколько крупных международных многоцентровых исследований (ALLHAT, EUROPA, PEACE), призванных уточнить возможную роль иАПФ в снижении частоты фатальных и нефатальных коронарных эпизодов у больных с документированной ИБС. В завершенном исследовании НОРЕ убедительно показана польза назначения иАПФ (рамиприла) в предупреждении инфаркта миокарда, мозгового инсульта и сердечно–сосудистых смертей.
В рамках саттелитного симпозиума (Европейский конгрес кардиологов, Берлин, 2002) Ferrari R. привел данные, что предварительное назначение иАПФ (периндоприла) снижает продукцию лактата (являющегося маркером ишемии) у больных ИБС при проведении теста частой предсердной стимуляции (вызывающей появление ишемии).
Таким образом, можно с уверенностью утверждать о большой роли иАПФ в предупреждении развития поражения органов–мишеней (и обратном развитии уже существующих изменений) у больных АГ.
Литература:
1. Чукаева И.И., Корочкин И.М., Прохорова Т.Ф. и соавт. Антиишемический и противовоспалительный эффекты ингибиторов ангиотензинпревращающего фермента и их роль в ремоделировании сердца у больных, перенесших инфаркт миокарда //Кардиология, 2000, 11, 17–23.
2. Шальнова С.А., Деев А.Д., Вихирева О.В. и соавт. Распространенность артериальной гипертонии в России: информированность, лечение, контроль // Профилактика заболеваний и укрепление здоровья.–2001;2:3–7.
3. Шальнова С.А., Деев А.Д., Оганов Р.Г., Шестов Д.Б. Роль систолического и диастолического давления для прогноза смертности от сердечно–сосудистых заболеваний//