Рациональная терапии артериальной гипертонии
Артериальная гипертония (АГ) является не только одним из наиболее широко распространенных заболеваний человечества, но и главным фактором риска сердечно–сосудистой и цереброваскулярной заболеваемости и смертности населения. АГ выявляется почти у 1 млрд человек (проживающих в основном в промышленно развитых странах), что составляет порядка 25–40% всего населения. При этом, по некоторым прогнозам, распространенность АГ будет лишь возрастать во всем мире в ближайшие годы [1,2]. Эпидемиологическая ситуация в России также крайне неблагоприятна, и возрастающий процент больных АГ в общей массе населения, к сожалению, становится общепризнанным фактом [3].
АГ считают стойкое повышение артериального давления (АД) до уровня более 140/90 мм рт.ст. В подавляющем большинстве случаев (90–95%) выявляется эссенциальная артериальная гипертензия, которая в нашей стране также называется гипертонической болезнью. В остальных случаях диагностируют вторичные или симптоматические формы АГ: почечные (3–4%), эндокринные (0,1–0,3%), гемодинамические, неврологические, стрессовые, обусловленные приемом некоторых веществ и АГ беременных. При этих формах артериальной гипертензии повышенное АД является лишь одним из многих симптомов основного заболевания.
Главной целью лечения больных АГ является максимальное снижение риска развития сердечно–сосудистых осложнений, таких как инфаркт миокарда, мозговой инсульт, хроническая сердечная или почечная недостаточность [4]. Важность снижения повышенного АД известна врачам давно. Установлено, что эффективный контроль уровня АД в среднем снижает частоту мозгового инсульта на 42%, а острого инфаркта миокарда – на 14% [4].
Тактика лечения АГ зависит от множества факторов и в первую очередь основывается на уровне повышения АД, наличии поражения органов–мишеней и сопутствующих заболеваний, что можно охарактеризовать общим термином – степень риска.
Алгоритм ведения пациентов с АГ можно представить следующим образом.
I. На 1–м этапе, после комплексного обследования больного, установления точного диагноза и определения всех присутствующих факторов риска, выбирают общую стратегию терапии. В группах пациентов с низким риском необходимо оценить степень снижения АД и контроля других факторов риска с помощью немедикаментозного лечения. Немедикаментозное лечение АГ включает в себя, в первую очередь, модификацию образа жизни, а именно соблюдение диеты с ограничением потребления поваренной соли, жиров и легкоусваиваемых углеводов, контроль и предотвращение стрессовых ситуаций, отказ от курения, ежедневную умеренную динамическую физическую активность. Рекомендуемая продолжительность немедикаментозного лечения до назначения антигипертензивных препаратов составляет 6–12 мес. В группах высокого и очень высокого риска, а в последнее время и в группе среднего риска, помимо немедикаментозной терапии рекомендуется безотлагательно начинать медикаментозную терапию [5–7].
II. На 2–м этапе определяют тактику медикаментозной терапии, что включает в себя выбор количества применяемых медикаментов. Всегда стоит помнить о том, что первоначальный выбор тактики медикаментозного лечения АГ часто играет ключевую роль в дальнейшей приверженности пациента к лечению. Удачный выбор является залогом высокой приверженности к лечению, неудачный означает отсутствие контроля АД или невыполнение предписаний врача, что в конечном итоге может приводить к развитию жизнеугрожающих сердечно–сосудистых осложнений [8]. На этом этапе решается главный вопрос о применении либо монотерапии, либо комбинированной терапии. Четкий ответ на этот вопрос получен в отечественных и европейских рекомендациях по диагностике и лечению АГ [5–7], где сказано, что монотерапия назначается лишь у больных с 1–й степенью повышения АД и низким риском развития сердечно–сосудистых осложнений. Правильность выбора определенного медикамента трудно переоценить. Однако этот выбор не всегда является простым, т.к. количество антигипертензивных препаратов в настоящее время велико, что нередко ставит врача, принимающего решение о наиболее рациональном выборе, в сложное положение. При высоком или очень высоком риске развития сердечно–сосудистых осложнений и наличии АГ 2–3–й степени показано назначение комбинированной антигипертензивной терапии. У этих больных показана лекарственная терапия потому, что немедикаментозные методы лечения оказываются безуспешными. Следует подчеркнуть, что назначение стартовой комбинированной антигипертензивной терапии показано при следующих клинических ситуациях [9]:
• повышении АД более 160/100 мм рт.ст.;
• поражении органов–мишеней;
• наличии сердечно–сосудистых и почечных осложнений АГ;
• сахарном диабете;
• почечной недостаточности;
• протеинурии.
Эффективная комбинированная терапия должна отвечать определенным требованиям [10]. Механизм действия применяемых комбинаций должен быть взаимодополняющим, при этом используемые препараты должны иметь гипотензивный синергизм в сравнении с каждым медикаментом в отдельности, а также препараты, составляющие комбинацию, должны обладать минимальным влиянием на гемодинамические и гуморальные параметры, т.е. быть метаболически нейтральными.
III. На 3–м этапе ведения пациента выбирается оптимальная комбинация антигипертензивных препаратов в конкретном клиническом случае. Существуют так называемые рациональные комбинации антигипертензивных препаратов, к которым относятся:
• ингибиторы ангиотензинпревращающего фермента (АПФ) + антагонисты кальция (АК) [5,6];
• ингибиторы АПФ + тиазидные диуретики;
• блокаторы рецепторов ангиотензина (БРА) + тиазидные диуретики;
• БРА + АК;
• тиазидные диуретики + β–адреноблокаторы;
• тиазидные диуретики + АК;
• β–адреноблокаторы + дигидропиридиновые АК.
Следует помнить о том, что в полной мере преимущества комбинированной терапии присущи только лишь вышеизложенным (рациональным) комбинациям. Выбор той или иной комбинации антигипертензивных препаратов в основном зависит от сопутствующих заболеваний.
Среди рациональных комбинаций заслуживает особого внимания комбинация ингибитора АПФ с АК, которая имеет не только преимущества с теоретических позиций основного механизма действия, но и обладает практически доказанной высокой антигипертензивной эффективностью. На российском фармацевтическом рынке эта комбинация представлена в виде препарата Экватор (Гедеон Рихтер, Венгрия), который успешно зарекомендовал себя при лечении АГ. Экватор является оригинальной фиксированной комбинацией ингибитора АПФ лизиноприла с АК амлодипином.
Низкодозовая комбинация Экватора содержит 5 мг амлодипина и 10 мг лизиноприла № 10 и № 30. Полнодозовая комбинация Экватора содержит 10 мг амлодипина и 20 мг лизиноприла № 10, № 30 и № 60.
Рассмотрим подробнее лекарственные средства, входящие в состав препарата Экватор. Лизиноприл является представителем группы ингибиторов АПФ. Данная группа препаратов, помимо гипотензивного действия, доказала свою эффективность касательно органопротективных свойств и значительного снижения риска развития таких сердечно–сосудистых осложнений, как инфаркт миокарда, мозговой инсульт, сердечная и почечная недостаточность, а также улучшения прогноза при АГ. Согласно имеющимся мета–анализам, этот класс препаратов уменьшает гипертрофию миокарда левого желудочка, что является весьма важным, учитывая высокую распространенность этой патологии у больных АГ. Также значительным аспектом в действии ингибиторов АПФ является выраженная нефропротекция, которая в основном связана со снижением повышенного внутриклубочкового давления и антипротеинурическим действием. Это свойство данной группы в конечном итоге приводит к предотвращению и замедлению темпов падения скорости клубочковой фильтрации и развития терминальной хронической почечной недостаточности. Помимо вышеперечисленного, ингибиторы АПФ снижают активность норадреналина и альдостерона, вызывают увеличение натрийуреза и уменьшение симпатической активности. Также было показано, что препараты этой группы значительно улучшают эластические характеристики крупных артерий, замедляют сосудистое ремоделирование и нормализуют нарушенную эндотелиальную функцию, что, по всей видимости, связано с уменьшением влияния ангиотензина–II на сосудистую стенку при применении ингибиторов АПФ. Благоприятное влияние на сосудистую стенку этих препаратов было доказано в таких крупных клинических исследованиях, как HOPE и EUROPA [12]. Что касается представителя ингибиторов АПФ лизиноприла, то этому препарату присущи все эффекты, характерные в общем для данного класса, но в отличие от большинства других препаратов лизиноприл не является пролекарством и не требует первичной метаболической активации в печени, что делает возможным применение лизиноприла при выраженной патологии печени. Также этот препарат не содержит сульфгидрильные группы, являющиеся причиной ряда побочных эффектов (нейтропения и протеинурия). Меньший риск конкурентного метаболизма обеспечивает большее преимущество лизиноприла при его комбинированном применения с другими препаратами.
Другой составляющей в препарате Экватор является АК амлодипин – это антагонист кальциевых каналов дигидропиридинового ряда 3–го поколения, который блокирует медленные кальциевые каналы (каналы L–типа) и препятствует внутриклеточной гиперкальциемии и сокращению гладкомышечной клетки, тем самым оказывая сосудорасширяющее действие. Амлодипин эффективно снижает АД, не влияя на частоту сердечных сокращений у пациентов с АГ. Применяется также при лечении стенокардии напряжения, в том числе эффективен при выраженном вазоспастическом компоненте ишемии.
Совместное применение амлодипина и лизиноприла усиливает сосудистое воздействие последнего за счет блокады кальциевых механизмов вазоконстрикции и атерогенеза, обеспечивает дополнительные антиангинальные, антиспастические и антисклеротические свойства. Помимо сложения всех терапевтических эффектов, лизиноприл ослабляет вызываемую амлодипином активацию ренин–ангиотензин–альдостероновой и симпато–адреналовой системы, что приводит к уменьшению рефлекторной тахикардии. Комбинация этих двух препаратов обеспечивает более чем 24–часовую продолжительность действия, что крайне важно для длительного и стабильного поддержания нормального уровня АД. По данным многоцентровых исследований, оба препарата относятся к средствам, улучшающим прогноз при сердечно–сосудистых заболеваниях [13–16].
Что касается доказательной базы для препарата Экватор при лечении АГ, то она представлена в полном объеме. Эффективность и хорошая переносимость Экватора былаи подтверждены в многоцентровом рандомизированном плацебо–контролируемом исследовании НAMLET, в котором при лечении больных АГ был достигнут целевой уровень артериального давления более чем в 90% случаев [17]. Также отмечена эффективность Экватора у больных АГ 1–3–й степени, имеющих высокий или очень высокий риск сердечно–сосудистых осложнений [18–20]. Благоприятное влияние применения препарата Экватор на органы–мишени было продемонстрировано в ряде работ, в частности отмечался регресс гипертрофии миокарда левого желудочка [21] и уменьшение массы миокарда левого желудочка [20,22].
Экватор обладает улучшенным профилем переносимости в сравнении с монотерапией лизиноприлом и амлодипином. Отек голеней на фоне приема амлодипина устраняет лизиноприл вследствие дилатации посткапиллярных венул и снижения гидростатического давления в капиллярах; кашель на фоне лизиноприла в некоторой степени ослабляет амлодипин. Также переносимость улучшается за счет использования более низких доз, необходимых для достижения целевого АД, чем при применении амлодипина и лизиноприла в монотерапии.
В реальной клинической практике пациента, страдающего изолированной АГ, встретить практически невозможно, наиболее часто повышенное давление сочетается с наличием ишемической болезни сердца, сердечной и почечной недостаточности, метаболического синдрома и сахарного диабета. Так, была показана эффективность Экватора и у больных с сахарным диабетом или метаболическим синдромом [23,24]. Другим немаловажным аспектом является поражение почек при АГ, в частности было показано, что применение Экватора у больных с хроническим гломерулонефритом не только эффективно стабилизирует АД, но также снижает активацию ренин–ангиотензин–альдостероновой системы [25] и улучшает показатели внутрипочечной гемодинамики [26], способствуя таким образом сохранению функции почек и замедляя прогрессирование хронической почечной недостаточности.
В заключение, обобщая имеющиеся данные, следует отметить, что фиксированная лекарственная комбинация лизиноприла и амлодипина – препарат Экватор – обладает высокой антигипертензивной активностью и хорошо переносится больными. Сочетание амлодипина и лизиноприла существенно превосходит по антигипертензивному действию каждый из компонентов, используемых в виде монотерапии. Применение этого препарата в клинической практике повышает приверженность пациентов к лечению такой опасной сердечно–сосудистой патологии, как АГ.
Литература
1. Преображенский Д.В., Сидоренко Б.А., Скорик А.В., Некрасова Н.И. Преимущества комбинированной терапии артериальной гипертензии: новая фиксированная комбинация ингибитора ангиотензинпревращающего фермента и антагониста кальция. Consilium Medicum, 2007, 9(11): 38–45.
2. Haller H. Effective management of hypertension with dihydropyridine calcium channel blocker–based combination therapy in patients at high cardiovascular risk. Int. J. Clin. Pract., 2008, 62(5): 781–790.
3. Оганов Р.Г. Развитие профилактической кардиологии в России. Кардиоваскулярная терапия и профилактика, 2004; 3(3), ч.1, с.10–14.
4. Mancia G., De Backer G., Dominiczak A. Et al. Guidelines for the management of arterial hypertension. The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur. Heart J., 2007, 28(12): 1462–1536.
5. Диагностика и лечение артериальной гипертензии. (Рекомендации Российского общества по артериальной гипертонии и Всероссийского научного общества кардиологов). Системные Гипертензии. 2010. №3, стр.3–26.
6. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document. J Hypertension 2009;27:2121–2158.
7. Обновление Европейских рекомендаций по лечению артериальной гипертензии: анализ Европейского Общества Гипертензии. Артериальная гипертензия, 2010, № 1, с.4–42.
8. Подзолков В.И., Осадчий К.К. Новые горизонты комбинированной терапии артериальной гипертензии. Лечащий врач, 2008, 6: 31–38.
9. Садовникова И.И. Комбинированная терапия при гипертонической болезни: нелегкие ответы на простые вопросы. РМЖ. 2008 г, том 16, № 7, стр.496–500.
10. Mancia G.,Grassi. Combination treatment of hypertension. High Blood Pressure.–1994;5:5–7.
11. Маколкин В.И. Совершенствование комбинированной терапии – путь к улучшению результатов лечения артериальной гипертонии. РМЖ. 2007; 15 (16): с. 1–3.
12. Скворцов В.В., Тумаренко А.В., Одинцов В.В., Скворцова Е.М. Комбинированное лечение гипертонической болезни: акцент на комбинацию антагонистов кальция и ингибиторов АПФ. РМЖ. 2011; 19(4); с. 253–257.
13. Преображенский Д.В., Сидоренко Б.А., Шабанова Е.Н. Амлодипин – антагонист кальция третьего поколения. Кардиология 1998; №2: с.66–73.
14. Фельдшерова Н.А., Семернин Е.Н.. Амлодипин – обзор клинически х исследований // Качественная клиническая практика.– 2002, №2, с.1–8.
15. Котовская Ю.В., Лобанкова Л.А. Лизиноприл: основные клинические исследования . Клин.фармакол. и терапия 2002; т.11, №4: с.49–51
16. Кутишенко Н.П., Марцевич С.Ю. Ингибитор ангиопревращающего фермента лизиноприл: особенности применения в кардиологии. Атмосфера.Кардиология 2007; №2: 1–4.
17. Фаршанг Ч. Преимущества комбинации лизиноприла и амлодипина при лечении артериальной гипертонии. Гипертония и нефрология // Журнал венгерского Общества Гипертонии и Нефрологии 2005; 8 (2): 72–78.
18. Протасов К.В., Синкевич Д.А., Дзизинский А.А. 27. Сорока Н.Ф., Бельская Е.С. Экватор – фиксированная комбинация лизиноприла и амлодипина в лечении больных артериальной гипертензией. //Здравоохранение (Республика Беларусь) 2007; №7: 17–21.
19. Фомина В.А., Шишкина Л.А., Агафонова В.С., и др. Опыт применения Экватора у больных артериальной гипертонией II и III степени; оценка эффективности и переносимости. // В сб.: «Российский национальный конгресс кардиологов. Повышение качества и доступности кардиологической помощи (материалы конгресса)». Кардиоваскулярная терапия и профилактика 2008; 7(6)б Приложение 1: 384–385.
20. Дзяк Г.В., Ханюков А.А., Кошка Т.А. Опыт использования комбинированного антигипертензивного препарата Экватор в лечении больных с артериальной гипертензией. // Укр. Мед. Часопис, 2008; 1(63) – I/II: 33–37.
21. Морозов С.Н., Донская А.А., Морозова Е.А. Эффективность терапии экватором больных с артериальной гипертонией (на примере г. Якутска). // Якутский медицинский журнал 2008; 4(24): 9–12.
22. Нечесова Т.А., Ливенцева М.М., Коробко И.Ю., Калинина Т.В. Влияние комбинированной антигипертензивной терапии препаратом «Экватор» на состояние органов–мишеней у больных артериальной гипертензией. // Укр. Мед. Часопис, 2008; 6(68) – XI/XII: 21–31.
23. Цой С.О., Жампеисов Н.К., Гайпов А.Э., Магзумова Г.Е. Эффективность комбинированной гипотензивной терапии при лечении больных сахарным диабетом 2 типа с ожирением. // В сб.: VI Конференция РДО. Клиническая нефрология. Нефрология и диализ 2009; 11 (№4): 335.
24. Фурсов А.Н., Чернавский С.В., Артюшкевич О.В., и др. Опыт использования комбинированного антигипертензивного препарата Экватор в лечении больных метаболическим синдромом. // Съезд терапевтов Юга России. Сборник тезисов. Ростов–на–Дону, 2009: 90–91.
25. Ландышев Ю.С. Георгиевская М.Н. Щербань Н.А. и др. Состояние ренин – ангиотензин – альдостероновой системы у больных хроническим гломерулонефритом на фоне проведения нефропротективной терапии амлодипином и лизиноприлом (комбинированный препарат «Экватор») // IV Национальный конгресс терапевтов. Сборник материалов. Москва, 2009; 143.
26. Ландышев Ю.С. Георгиевская М.Н. Щербань Н.А. и др. Гемодинамические критерии эффективности комбинированной терапии лихзиноприлом и амлодипином (комбинированный препарат Экватор) у больных хроническим гломерулонефритом. // III Национальный конгресс терапевтов. Сборник материалов. Москва, 2008; 141.
Источник
Комментарии
Опубликовано в издании:
«Сердце: журнал для практикующих врачей» Том 12, № 1 (69), 2013г.
Сергеева–Кондраченко М. Ю.
ГБОУ ДПО «Пензенский институт усовершенствования врачей» Минздрава РФ
Резюме
Актуальность. Выбор антигипертензивных препаратов у больных СД 2 типа имеет особое значение, поскольку это заболевание накладывает целый ряд ограничений к применению того или иного лекарственного средства.
Цель. Оценка влияния препарата Престанс (комбинация периндоприла и амлодипина) на суточный профиль АД, углеводный и липидный обмен, прогрессирование диабетической нефропатии у пациентов с СД 2 типа и АГ.
Материалы и методы. Под динамическим наблюдением находились 57 больных СД 2 типа и АГ. После «отмывочного» периода (в течение 5–7 дней бальные не принимали антигипертензивную терапию) пациенты получали Престанс (5 / 5, 5 / 10, 10 / 5, 10 / 10 мг) на протяжении 6 месяцев. Контролировались АД, состояние углеводного и липидного обмена, функция почек.
Результаты. Прием препарата привел к достижению целевого уровня АД у 98 % больных АГ и СД 2 типа, обеспечил устойчивый контроль АД в течение 24 часов. Достоверно снизился уровень ХС, ХС ЛПНП и повысился уровень ХС НПВП, достоверно снизился уровень микроальбуминурии (–35,5 % (р Заключение. Высокая антигипертензивная эффективность лечения при использовании препарата сочетается с благоприятным влиянием на почечную гемодинамику, углеводный и липидный обмен.
Ключевые слова: антигипертензивная терапия, артериальная гипертензия, сахарный диабет
По данным Всемирной Федерации Диабета (IDF) на 2010 г. в Российской Федерации насчитывалось около 9624900 людей, страдающих СД, из которых более 80–90 % – это пациенты с СД 2 типа. Во всем мире СД 2 типа представляет важнейшую медико-социальную проблему не только по причине высокой распространенности и темпов прогрессии численности больных. СД 2 типа характеризуется хроническим, прогрессируюшим течением, ассоциирован с высокой инвалидизацией ввиду развития многочисленных микро- и макрососудистых осложнений, а также сохранения лидирующих позиций среди основных причин смерти. Обобщенные данные многочисленных эпидемиологических исследований свидетельствуют, что более 70–80 % больных СД 2 типа имеют сопутствующую АГ, что обусловлено общими патогенетическими механизмами указанных заболеваний и сопровождается развитием сходных метаболических и сосудистых нарушений [1, 2].
Выбор антигипертензивных препаратов у больных СД 2 типа имеет особое значение, поскольку это заболевание накладывает целый ряд ограничений к применению того или иного лекарственного средства. Необходимо учитывать спектр его побочных действий, воздействие на углеводный и липидный обмен, а также наличие сопутствующих сосудистых осложнений у больного. Поэтому антигипертензивные препараты при лечении больных СД должны отвечать повышенным требованиям: обладать высокой антигипертензивной активностью при минимуме побочных эффектов; не нарушать углеводный и липидный обмен; обладать кардиопротективным и нефропротективным действием; не ухудшать течение других (не сосудистых) осложнений СД [3].
Важно помнить, что снижение АД должно происходить медленно, постепенно достигая целевых уровней. Особенно осторожно следует проводить лечение пожилых больных, а также перенесших мозговой инсульт или ИМ. Количество и конкретный выбор назначаемых препаратов зависят от исходной величины АД, длительности АГ, сопутствующих заболеваний, суммарного риска.
В настоящее время пациентам с СД 2 типа рекомендуется стартовая комбинированная терапия. Поскольку антигипертензивная терапия должна быть длительной (чаще пожизненной), то предпочтение необходимо отдавать препаратам пролонгированного действия, обеспечивающим 24-часовой контроль при однократном приеме, если комбинации, то лучше фиксированной – в одной таблетке.
Препарат Престанс («Лаборатории Сервье», Франция) является представителем новой генерации гипотензивных препаратов, поскольку включает в себя иАПФ – периндоприл аргинин и блокатор кальциевых каналов (БКК) – амлодипин. Престанс обладает выраженным гипотензивным действием, а каждый из препаратов, его составляющих, амлодипин и периндоприл аргинин, так же как и их сочетание, имеют большую доказательную базу клинической эффективности. Престанс – метаболически нейтральный препарат, снижающий центральное АД (давление в аорте), уменьшающий вариабельность САД, контролирующий АД в ночное время и имеющий широкий выбор фиксированных дозировок.
Цель исследования – оценка влияния препарата Престанс на суточный профиль АД, углеводный и липид-ный обмен, прогрессирование диабетической нефропатии у пациентов с СД 2 типа и АГ.
Материалы и методы
Под динамическим наблюдением находилось 57 больных СД 2 типа и АГ. Пациенты принимали пероральные сахароснижающие препараты из группы сульфаниламидов или комбинации сульфаниламидов и бигуанидов (метформин). Большинство обследуемых больных нуждались в коррекции сахароснижающей терапии, которая проводилась на старте и оставалась неизменной в течение всего периода наблюдения. Кроме того, с пациентами на момент включения в исследование проводились беседы о немедикаментозной коррекции нарушений углеводного обмена и АГ (диета, физическая активность).
На добровольной основе больные не принимали анти-гипертензивные препараты за 5–7 дней до включения в исследование («отмывочный период»). С целью коррекции АГ пациенты получали Престанс (5 / 5, 5 / 10, 10 / 5, 10 / 10 мг) на протяжении 6 месяцев. Исходно, через 4, 8, 12, 16, 20 и 24 недели лечения контролировали АД, состояние углеводного и липидного обменов, уровень креатинина, печеночных ферментов в крови, уровень микроальбуминурии.
Суточное мониторирование АД (СМАД) проводили с помощью неинвазивной портативной системы «SpaceLabs Medical» 90207 (США). В дневное время (период бодрствования с 7 до 23 часов) показатели СМА Д регистрировали каждые 15 минут, в ночное время (период сна с 23 до 7 часов) – каждые 30 минут. После обработки данных анализировались следующие показатели СМАД: средние значения САД, ДАД, ЧСС, «нагрузку давлением» оценивали по индексу времени (ИВ), который определялся процентом измерений АД, превышающих 130 / 85 мм рт. ст. за сутки: 140 / 90 мм рт. ст. в дневные часы и 120 / 80 мм рт. ст. в ночные часы. Выраженность двухфазного ритма АД определяли по величине суточного индекса САД и ДАД (СИ АД); рассчитывали скорость утреннего подъема АД (СУП АД).
Уровень HbA1c определялся при включении больных в исследование, через 3 и 6 месяцев наблюдения. HbA1C исследовался количественным определением, методом иммуноингибирования на аппарате «Olympus AU 400» с помощью реактива «Olympus AU 400» (Япония) автоматическим определением уровня гемоглобина крови и вычислением процентного соотношения HbA1С от общего.
Исследование гликемии в течение 3-х суток осуществлялось при включении больных, через 3 и 6 месяцев с помощью прибора для непрерывного мониторирования глюкозы крови – CGMS (Continuous Glucose Monitoring System) аппаратом CGMS System Gold MMT-7102 фирмы Medtronic MiniMed, США. Обработка результатов непрерывного мониторирования гликемии проводилась с помощью специальной компьютерной программы.
Кроме того, больные на протяжении 6 месяцев оценивали состояние компенсации углеводного обмена по гли-кемическому профилю. Гликемия определялась в 8 точках один раз в неделю, а в другие дни 3-кратно в течение дня. Уровень гликемии исследовался с помощью глюкометра «Accu-Check Go» фирмы Roche, Германия. Антропометрическое исследование включало расчет ИМТ. Липидный спектр крови определяли с помощью наборов фирмы «Вектор бест» (Новосибирск) на спектрофотометре BioSpec mini фирмы Shimadzu (Япония). Исследовали содержание общего ХС, ТГ, ХС ЛПВП. ХС ЛПНП и ХС ЛПОНП подсчитывали по формуле Фридвалда. Для определения экскреции альбумина использовались тест-полоски «М-альбучек» и «Микраль-тест II» (Roche). Исследовалась утренняя порция мочи. Статистическая обработка результатов исследования проводилась с использованием пакета STATISTICA (версия 6.0). При создании базы данных использовали редактор электронных таблиц MS Exel 7.0. Достоверным считался уровень значимости р Результаты
Средний возраст обследуемых составил 56±2,5 лет, преобладали женщины – 35 (61 %). Средняя продолжительность АГ в исследуемой группе составила 8,3±1,5 лет, длительность СД 2 типа – 12,1±1,2 лет, среднее значение АД – 168±11 и 105±7 мм рт. ст. – для САД и ДАД соответственно, ИМТ – 37,1±1,7 кг / м2.
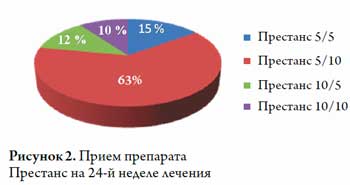
К 8 недели наблюдения 98 % пациентов достигли целевого АД (130 / 80 мм рт. ст.) и удерживали его до 24 недели наблюдения, о чем свидетельствовали результаты СМАД (8, 16 и 24 недели наблюдения) (рис. 1). 15 % пациентов получали Престанс в дозе 5 / 5 мг, 63 % — в дозе 5 / 10 мг, 12 % пациентов в дозе — 10 / 5 мг и 10 % — в дозе 10 / 10 мг (рис. 2).
Лечение комбинацией периндоприла и амлодипина через 2 месяца (8-я неделя наблюдения) привело к достоверно значимому снижению от исходного уровня содержания общего ХС плазмы крови, ХС ЛПНП и ТГ, а также к повышению ХС ЛПВП. Вышеуказанные изменения сохранялись до 24 недели наблюдения на фоне препарата Престанс (табл. 1).
Таблица 1.
Клиническая характеристика больных
| Показатель | Характеристика | ||
|---|---|---|---|
| (при включении в исследование) | (24-я неделя наблюдения) | ||
| Количество включенных больных | 57 | 57 | |
| Пол | Женщины | 35 (61 %) | |
| Мужчины | 22 (39 %) | ||
| Возраст, годы (mean±SD) | 56±2,5 | ||
| Длительность артериальной гипертензии, годы | 8,3±1,5 | ||
| Длительность СД 2 типа, годы | 12,1±1,2 | ||
| ИМТ, кг / м2 | 37,1±1,7 | 33,8±0,3* | |
| САД, мм рт. ст. | 168±11 | 130±3* | |
| ДАД, мм рт. ст. | 105±7 | 78±2* | |
| ОХС, ммоль / л | 6,3±0,4 | 4,9±0,2* | |
| ХСЛПВП, ммоль / л | 0,9±0,2 | 1,1±0,1* | |
| ХСЛПНП, ммоль / л | 3,8±0,3 | 3,0±0,3* | |
| TГ, моль / л | 2,6±0,3 | 1,7±0,2* | |
| Гликемия натощак, ммоль / л | 7,5±0,4 | 7,0±0,2* | |
| Гликемия через 2 часа после завтрака, ммоль / л | 8,2±0,5 | 8,0±0,3 | |
| Гликемия перед обедом, ммоль / л | 7,6±0,3 | 7,2±0,3* | |
| Гликемия через 2 часа после обеда, ммоль / л | 8,4±0,6 | 7,4±0,2* | |
| Гликемия перед ужином, ммоль / л | 7,1±0,3 | 6,8±0,3 | |
| Гликемия через 2 часа после ужина, ммоль / л | 7,8±0,4 | 7,5±0,4 | |
| Гликемия перед сном, ммоль / л | 6,7±0,2 | 6,3±0,2* | |
| Уровень HbA1С , % | 7,6±0,3 | 7,1±0,2* | |
| * – достоверное отличие. | |||
При использовании Престанса через 3 месяца ИМТ достоверно снизился и составил 35,3±0,5 кг / м2, а через 6 месяцев — 33,8±0,3 кг / м2. На вышеуказанном препарате за 24 недели наблюдения тощаковая гликемия снизилась на 0,5±0,2 ммоль / л, а постпрандиальная (через 2 часа после обеда) на 1,0±0,4 ммоль / л. Уровень HbA1C при включении пациентов в исследование равнялся 7,6±0,3 %, а к 24 недели наблюдения составил 7,1±0,2 %.
Результаты исследования показали, что Престанс оказывает и ренопротективное действие, достоверно снижая уровень микроальбуминурии (–35,5 %, рВсе пациенты, принимающие участие в исследовании, отмечали хорошую переносимость препарата.
Литература
1. Аметов А. С. Сахарный диабет 2 типа. Проблемы и решения. – М.: ГЭОTАР – Медиа, 2011. – 704 с.
2. Дедов и. и., Шестакова М. В. Сахарный диабет и артериальная гипертензия. – М.: ООО «Медицинское информационное агентство», 2006. – 344 с.
3. Диагностика и лечение артериальной гипертензии. Российские рекомендации (4й пересмотр). Системные гипертензии. 2010;3:3–25.
Комментарии (видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник

