Церебральное перфузионное давление повышено
Церебральное перфузионное давление (у здоровых людей — 75 — 90 мм рт. см., или 10 — 12 кПа) представляет собой разницу между средним артериальным давлением1 (в норме — 90 — 100 мм рт. ст., или 12 — 13,3 кПа) и венозным церебральным давлением, причем последнее практически соответствует ликворному давлению, равному в норме 150 — 200 мм вод. ст., или 1,5 — 2 кПа [Маrх Р., 1980].
Оптимальными параметрами, обеспечивающими стабильное перфузионное давление на уровне 75 — 90 мм рт. ст., или 10 — 12 кПа, являются: среднее артериальное давление 90 — 100 мм рт. ст., или 12 — 13,3 кПа, и внутричерепное давление 170 — 180 мм вод. ст., или 1,7-1,8 кПа [Gobiet W., 1980].
Механизм ауторегуляции продолжает функционировать, предупреждая пассивные изменения мозгового кровотока в ответ на колебания давления в большом круге кровообращения, только при условии, что среднее артериальное давление не выходит за пределы 60 — 160 мм рт. ст., или 8 — 21 кПа [Herrschaft Н., 1976; Barolin G., 1982].
Резкая гипо- или гипертензия в большом круге кровообращения нарушает ауторегуляцию мозгового кровотока. Повышение церебрального перфузионного давления вызывает вазоконструкцию, т. е. увеличение сосудистого сопротивления в артериальной системе мозга, а снижение перфузионного давления — вазодилатацию (снижение сосудистого сопротивления). Механизм изменения диаметра сосудов мозга в зависимости от перфузионного давления не имеет пока однозначного объяснения. Миогенная теория основана на том, что каждое растяжение гладкой мускулатуры сосудистой стенки сразу влечет за собой сокращение мышечных волокон (эффект Бейлисса).
Согласно нейрогенной теории, повышение перфузионного давления является рефлекторным ответом на вазоконстрикцию. В последнее время установлено, что оба указанных механизма тесно связаны с изменениями газового состава крови, а также тканевого метаболизма и регулируются или модифицируются ими. Влияние изменений рН, Рсо2, артериальной крови и тканевого PО2 на мозговой кровоток.
Приведенные данные доказывают зависимость уровня мозгового кровотока от газового состава крови, т. е., в конечном счете, от сочетания циркуляторной гипоксии с нарушениями в системах внешнего и тканевого дыхания.
«Неотложные состояние в невропатологии», Б.С.Виленский
Смотрите также:
- Апнейстическое дыхание (apneusis)
- Экстремальные нарушения жизнедеятельности
- Оксигенация мозга и причины ее нарушений
- Апнейстическое дыхание (Интубация)
- Смерть мозга (тотальная гибель всех структур головного мозга)
- Поражения мозга вследствие гипоксии
- Апнейстическое дыхание (Аускультация обоих лёгких)
- Смерть мозга (Клинические критерии)
- Поражения мозга вследствие гипоксии (ГАМК)
- Апнейстическое дыхание (Наблюдение за состоянием больного)
- Смерть мозга (Обязательные критерии смерти мозга)
- Степень, быстрота возникновения и распространенность изменений микроциркуляции
- Апнейстическое дыхание (Использование простейших приемов искусственного дыхания)
- Биологическая смерть (Характеристика)
- Гиперкапния
- Интенсивная терапия нарушений дыхания
- Гиперкапния (Возбуждение дыхательного центра)
Источник
Церебральное
перфузионное давление (ЦПД) —
это разница
между средним артериальным давлением
(АДср) и ВЧД (или церебральным венозным
давлением). Если церебральное венозное
давление значительно превышает ВЧД, то
ЦПД равно разнице между АДср и церебральным
венозным давлением. В
физиологических условиях ВЧД незначительно
отличается от церебрального венозного
давления, поэтому принято считать, что
ЦПД = АДср — ВЧД. В норме церебральное
перфузионное давление составляет 100 мм
рт. ст. и зависит главным образом от
АДср, потому что ВЧД у здорового человека
не превышает 10 мм рт. ст.
При
выраженной внутричерепной гипертензии
(ВЧД > 30 мм рт. ст.) ЦПД и МК могут
значительно снижаться даже при нормальном
АДср. ЦПД < 50 мм рт. ст. проявляется
замедлением ритма на ЭЭГ, ЦПД в пределах
от 25 до 40 мм рт. ст. — изолинией на ЭЭГ,
а при устойчивом снижении ЦПД менее 25
мм рт. ст. возникает необратимое
повреждение мозга.
2. Ауторегуляция мозгового кровообращения
В
головном мозге, так же как в сердце и
почках, даже значительные колебания АД
не оказывают существенного влияния на
кровоток. Сосуды мозга быстро реагируют
на изменение ЦПД. Снижение ЦПД вызывает
вазодилатацию сосудов мозга, увеличение
ЦПД — вазоконстрикцию. У здоровых людей
МК остается неизменным при колебаниях
АДср в пределах от 60 до 160 мм рт. ст. (рис.
25-1). Если АДср выходит за границы этих
значений, то ауторегуляция МК нарушается.
Увеличение АДср до 160 мм рт. ст. и выше
вызывает повреждение гематоэнцефалического
барьера (см. ниже), чреватое отеком мозга
и геморрагическим инсультом.
При
хронической артериальной гипертонии
кривая
ауторегуляции мозгового кровообращения
(рис. 25-1)
смещается вправо,
причем сдвиг
затрагивает и нижнюю, и верхнюю границы.
При артериальной гипертонии снижение
АД до обычных значений (меньше измененной
нижней границы) приводит к уменьшению
МК, в то время как высокое АД не вызывает
повреждения мозга. Длительная гипотензивная
терапия может восстановить ауторегуляцию
мозгового кровообращения в физиологических
границах.
Существуют
две теории ауторегуляции мозгового
кровообращения — миогенная и
метаболическая. Миогенная теория
объясняет механизм ауторегуляции
способностью гладкомышечных клеток
церебральных артериол сокращаться и
расслабляться в зависимости от АДср.
Согласно метаболической теории, тонус
церебральных артериол зависит от
потребности мозга в энергетических
субстратах. Когда потребность мозга в
энергетических субстратах превышает
их доставку, в кровь выделяются тканевые
метаболиты, которые вызывают церебральную
вазодилатацию и увеличение МК. Этот
механизм опосредуют ионы водорода (их
роль в церебральной вазодилатации
описана раньше), а также другие вещества
— оксид азот (NO), аденозин, простагландины
и, возможно, градиенты ионной концентрации.
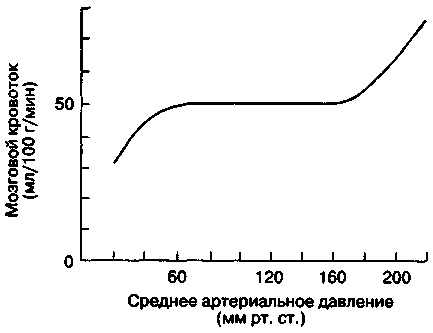
Рис.
25-1. Ауторегуляция
мозгового кровообращения
3. Внешние факторы
Парциальное
давление СО2
и О2
в крови
Парциальное
давление СO2
в артериальной крови (РаСО2)
— наиболее важный внешний фактор,
влияющий на МК. МК
прямо пропорционален РаСО2
в пределах от 20 до 80ммрт. ст. (рис.
25-2). Увеличение РаСO2
на 1 мм рт. ст. влечет за собой мгновенное
повышение МК на 1-2 мл/100 г/мин, уменьшение
РаСО2
приводит к эквивалентному снижению МК.
Этот эффект опосредуется через рН
цереброспинальной жидкости и вещества
мозга. Поскольку
СО’2, в отличие от ионов, легко проникает
через гематоэнцефалический барьер, то
на МК влияет именно острое изменение
РаСО?, а не концентрации HCOj . Через
24-48 ч после начала гипо- или гиперкапнии
развивается компенсаторное изменение
концентрации НСОз~ в спинномозговой
жидкости. При выраженной гипервентиляции
(РаСО2
< 20 мм рт. ст.) даже у здоровых людей на
ЭЭГ появляется картина, аналогичная
таковой при повреждении головного
мозга. Острый метаболический ацидоз не
оказывает значительного влияния на МК,
потому что ион водорода (Н+)
плохо проникает через гематоэнцефалический
барьер. Что касается РаО2,
то на МК оказывают воздействие только
его значительные изменения. В то время
как гипероксия снижает МК не более чем
на 10 %, при тяжелой гипоксии (РаО2
< 50 мм рт. ст.) МК увеличивается в гораздо
большей степени (рис. 25-2).
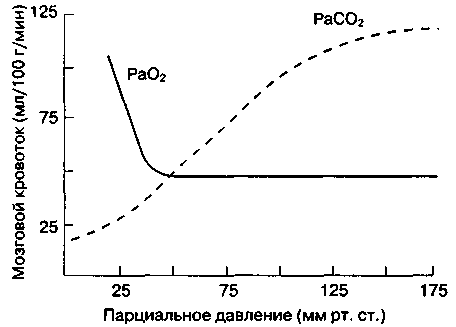
Рис.
25-2. Влияние РаО2
и РаСО2на
мозговой кровоток
Температура
тела
Изменение
МК составляет 5-7 % на 1 °С. Гипотермия
снижает CMRO2
и МК, в то время как гипертермия оказывает
обратный эффект. Уже
при 20 °С на ЭЭГ регистрируют изолинию,
но дальнейшее уменьшение температуры
позволяет еще сильнее снизить потребление
кислорода мозгом. При температуре выше
42 °С потребление кислорода мозгом также
снижается, что, по-видимому, обусловлено
повреждением нейронов.
Вязкость
крови
У
здоровых людей вязкость крови не
оказывает значительного влияния на МК.
Вязкость крови в наибольшей степени
зависит от гематокрита, поэтому снижение
гематокрита уменьшает вязкость и
увеличивает МК. К сожалению, помимо
этого благоприятного эффекта, снижение
гематокрита имеет и отрицательную
сторону: оно уменьшает кислородную
емкость крови и, соответственно, доставку
кислорода. Высокий гематокрит, например
при тяжелой полицитемии, увеличивает
вязкость крови и снижает МК. Исследования
показали, что для лучшей доставки
кислорода к мозгу гематокрит должен
составлять 30-34 %.
Вегетативная
нервная система
Внутричерепные
сосуды иннервируются симпатическими
(вазоконстрикторными), парасимпатическими
(вазодилатирующими) и нехолинергическими
неадренергическими волокнами;
нейротрансмитте-ры в последней группе
волокон — серотонин и вазоактивный
интестинальный пептид. Функция
вегетативных волокон сосудов мозга в
физиологических условиях неизвестна,
но продемонстрировано их участие при
некоторых патологических состояниях.
Так, импульсация по симпатическим
волокнам из верхних симпатических
ганглиев может значительно сузить
крупные мозговые сосуды и уменьшить
МК. Вегетативная иннервация мозговых
сосудов играет важную роль в возникновении
церебрального вазоспазма после Ч МТ и
инсульта.
Гематоэнцефалический
барьер
Между
эндотелиальными клетками мозговых
сосудов практически отсутствуют поры.
Малочисленность пор — основная
морфологическая особенность
гематоэнцефалического
барьера. Липидный
барьер проницаем для жирорастворимых
веществ, но значительно ограничивает
проникновение ионизированных частиц
и крупных молекул. Таким
образом, проницаемость гематоэнцефалического
барьера для молекулы какого-либо вещества
зависит от ее размера, заряда, липо-фильности
и степени связывания с белками крови.
Углекислый газ,
кислород и липофильные вещества (к
которым относят большинство анестетиков)
легко проходят через гематоэнцефалический
барьер, в то время как для большинства
ионов, белков и крупных молекул (например,
маннитола) он практически непроницаем.
Вода
свободно проникает через гематоэнцефалический
барьер по механизму объемного тока, а
перемещение даже небольших ионов
затруднено (время полувыравнивания для
натрия составляет 2-4 ч). В результате
быстрые изменения концентрации
электролитов плазмы (а значит, и
осмолярности) вызывают преходящий
осмотический градиент между плазмой и
мозгом. Остро возникшая гипер-тоничность
плазмы приводит к перемещению воды из
вещества мозга в кровь. При острой
гипотонич-ности плазмы, наоборот,
происходит перемещение воды из крови
в вещество мозга. Чаще всего равновесие
восстанавливается без особых последствий,
но в ряде случаев существует опасность
быстро развивающихся массивных
перемещений жидкости, чреватых
повреждением мозга. Следовательно,
значительные нарушения концентрации
натрия или глюкозы в плазме нужно
устранять медленно (см. гл. 28) Маннитол,
осмотически активное вещество, которое
в физиологических условиях не пересекает
гематоэнцефалический барьер, вызывает
устойчивое уменьшение содержания воды
в мозге и часто используется для
уменьшения объема мозга.
Целостность
гематоэнцефалического барьера нарушают
тяжелая артериальная гипертензия,
опухоли мозга, ЧМТ, инсульт, инфекции,
выраженная гиперкапния, гипоксия,
устойчивая судорожная активность При
этих состояниях перемещение жидкости
через гематоэнцефалический барьер
определяется не осмотическим градиентом,
а гидростатическими силами.
Цереброспинальная
жидкость
Цереброспинальная
жидкость находится
в желудочках и цистернах головного
мозга, а также в суб-арахноидальном
пространстве ЦНС. Главная функция
цереброспинальной жидкости — защита
мозга от травмы.
Большая
часть цереброспинальной жидкости
вырабатывается в сосудистых сплетениях
желудочков мозга (преимущественно в
боковых). Некоторое количество образуется
непосредственно в клетках эпендимы
желудочков, а совсем небольшая часть —
из жидкости, просачивающейся через
периваскулярное пространство сосудов
мозга (утечка через гематоэнцефалический
барьер). У взрослых образуется 500 мл
цереброспинальной жидкости в сутки (21
мл/ч), в
то время как объем цереброспинальной
жидкости составляет только 150 мл. Из
боковых желудочков цереброспинальная
жидкость через межжелудочковые отверстия
(отверстия Монро) проникает в третий
желудочек, откуда через водопровод
мозга(сильвиев водопровод) попадает в
четвертый желудочек. Из четвертого
желудочка через срединную апертуру
(отверстие Мажанди) и боковые апертуры
(отверстия Люшка) цереброспинальная
жидкость поступает в мозжечково-мозговую
(большую) цистерну (рис. 25-3), а оттуда —
в субарахноидальное пространство
головного и спинного мозга, где и
циркулирует до тех пор, пока не всасывается
в грануляциях паутинной оболочки больших
полушарий. Для образования цереброспинальной
жидкости необходима активная секреция
натрия в сосудистых сплетениях.
Цереброспинальная жидкость изото-нична
плазме, несмотря на более низкую
концентрацию калия, бикарбоната и
глюкозы. Белок поступает в цереброспинальную
жидкость только из перивас-кулярных
пространств, поэтому его концентрация
очень невелика. Ингибиторы карбоангидразы
(аце-тазоламид), кортикостероиды,
спиронолактон, фу-росемид, изофлюран и
вазоконстрикторы уменьшают выработку
цереброспинальной жидкости.
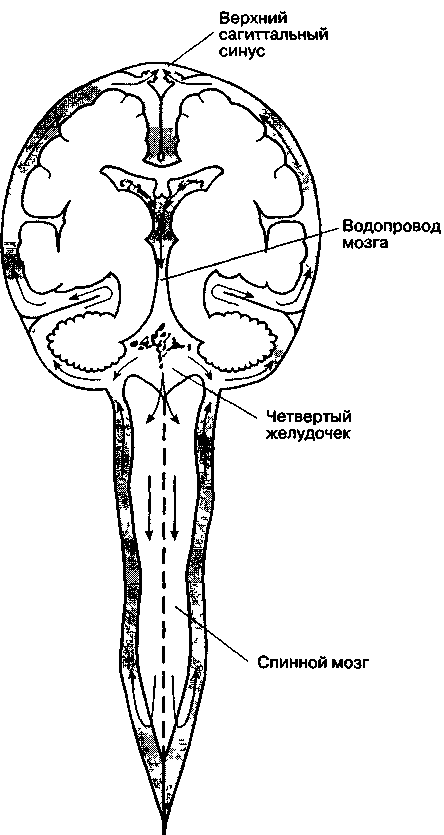
Рис.
25-3. Циркуляция
цереброспинальной жидкости в центральной
нервной системе. (С разрешения Из De-Groot
J., Chusid J. G. Correlative
Neuroanatomy, 21st ed.
Appleton & Lange, 1991.)
Цереброспинальная
жидкость всасывается в грануляциях
паутинной оболочки, откуда попадает в
венозные синусы. Небольшое количество
всасывается через лимфатические сосуды
мозговых оболочек и периневральные
муфты. Обнаружено, что всасывание прямо
пропорционально ВЧД и обратно
пропорционально церебральному венозному
давлению; механизм этого явления неясен.
Поскольку в головном и спинном мозге
нет лимфатических сосудов, всасывание
цереброспинальной жидкости — основной
путь возвращения белка из интерстициальных
и периваскулярных пространств мозга
обратно в кровь.
Источник
Церебральное
перфузионное давление (ЦПД) —
это
разница между средним артериальным
давлением
(АДср) и ВЧД (или церебральным венозным
давлением).
Если церебральное венозное давление
значительно
превышает ВЧД, то ЦПД равно разнице
между АДср и церебральным венозным
давлением.
В
физиологических условиях ВЧД незначительно
отличается от церебрального венозного
давления,
поэтому принято считать, что ЦПД = =
АДср — ВЧД. В норме церебральное
перфузионное
давление составляет 100 мм рт. ст. и зависит
главным
образом от АДср, потому что ВЧД у
здорового
человека не превышает 10 мм рт. ст.
При
выраженной внутричерепной гипертензии
(ВЧД
> 30 мм рт. ст.) ЦПД и MK
могут значительно
снижаться даже при нормальном АДср. ЦПД
<
50 мм рт. ст. проявляется замедлением
ритма на ЭЭГ,
ЦПД в пределах от 25 до 40 мм рт. ст. —
изолинией
на ЭЭГ, а при устойчивом снижении ЦПД
менее
25 мм рт. ст. возникает необратимое
повреждение
мозга.
2. Ауторегуляция мозгового кровообращения
В
головном мозге, так же как в сердце и
почках, даже значительные колебания АД
не оказывают существенного
влияния на кровоток. Сосуды мозга
быстро реагируют на изменение ЦПД.
Снижение
ЦПД вызывает вазодилатацию сосудов
мозга, увеличение
ЦПД — вазоконстрикцию. У здоровых людей
MK
остается неизменным при колебаниях
АДср
в пределах от 60 до 160 мм рт. ст. (рис. 25-1).
Если
АДср выходит за границы этих значений,
то ауторегуляция
MK
нарушается. Увеличение АДср до
160 мм рт. ст. и выше вызывает повреждение
ге-матоэнцефалического
барьера (см. ниже), чреватое
отеком мозга и геморрагическим инсультом.
При
хронической артериальной гипертонии
кривая
ауторегуляции мозгового кровообращения
(рис.
25-1) смещается
вправо, причем
сдвиг затрагивает
и нижнюю, и верхнюю границы. При
артериальной
гипертонии снижение АД до обычных
значений (меньше измененной нижней
границы)
приводит к уменьшению MK,
в то время как высокое
АД не вызывает повреждения мозга.
Длительная
гипотензивная терапия может восстановить
ауторегуляцию мозгового кровообращения
в
физиологических границах.
Существуют
две теории ауторегуляции мозгового
кровообращения — миогенная и
метаболическая.
Миогенная теория объясняет механизм
ауторегуляции
способностью гладкомышечных клеток
церебральных
артериол сокращаться и расслабляться
в зависимости от АДср. Согласно
метаболической
теории, тонус церебральных артериол
зависит
от потребности мозга в энергетических
субстратах.
Когда потребность мозга в энергетических
субстратах
превышает их доставку, в кровь выделяются
тканевые метаболиты, которые вызывают
церебральную
вазодилатацию и увеличение MK.
Этот
механизм опосредуют ионы водорода (их
роль
в церебральной вазодилатации описана
раньше),
а также другие вещества — оксид азот
(NO),
аденозин,
простагландины и, возможно, градиенты
ионной
концентрации.
3. Внешние факторы
Парциальное
давление CO2
и O2
в крови
Рис.
25-1. Ауторегуляция
мозгового кровообращения
Парциальное
давление CO2
в артериальной крови (PaCO2)
— наиболее важный внешний фактор,
влияющий
на MK.
MK
прямо пропорционален PaCO2
в
пределах от 20 до ЗОммрт. ст. (рис.
25-2). Увеличение PaCO2
на 1 мм рт. ст. влечет за собой мгновен-
ное повышение MK
на 1-2 мл/100 г/мин, уменьшение
PaCO2
приводит к эквивалентному снижению
MK.
Этот эффект опосредуется через рН
цереброспинальной
жидкости и вещества мозга. Поскольку
CO2,
в отличие от ионов, легко проникает,
через гематоэнцефалический барьер, то
на MKвлияет
именно острое изменение PaCO2,
а не концентрации
HCO3‘.
Через 24-48 ч после
начала гипо-
или гиперкапнии развивается компенсаторное
изменение концентрации HCO3″
в спинномозговой
жидкости. При выраженной гипервентиляции
(PaCO2
< 20 мм рт. ст.) даже у здоровых людей на
ЭЭГ появляется картина, аналогичная
таковой при повреждении головного
мозга. Острый метаболический ацидоз
не оказывает значительного влияния
на MK,
потому что ион водорода (H+)
плохо
проникает через гематоэнцефалический
барьер. Что
касается PaO2,
то на MK
оказывают воздействие
только его значительные изменения. В
то время
как гипероксия снижает MK
не более чем на 10 %, при тяжелой гипоксии
(PaO2
< 50 мм рт. ст.) MK
увеличивается
в гораздо большей степени (рис. 25-2).
Температура
тела
Изменение
MK
составляет 5-7 % на 1 0C.
Гипотермия
снижает CMRO2
и MK,
в то время как гипер-термия оказывает
обратный эффект. Уже
при 20
0C
на ЭЭГ регистрируют изолинию, но
дальнейшее
уменьшение температуры позволяет еще
сильнее снизить
потребление кислорода мозгом. При
температуре выше 42 0C
потребление кислорода мозгом
также снижается, что, по-видимому,
обусловлено повреждением нейронов.
Вязкость
крови

Рис.
25-2. Влияние
PaO2
и PaCO2Ha
мозговой кровоток
У здоровых людей вязкость
крови не оказывает значительного влияния
на MK.
Вязкость крови
в
наибольшей степени зависит от гематокрита,
поэтому снижение
гематокрита уменьшает вязкость и
увеличивает MK.
К сожалению, помимо этого благоприятного
эффекта, снижение гематокрита имеет и
отрицательную сторону: оно уменьшает
кислородную
емкость крови и, соответственно, доставку
кислорода. Высокий гематокрит, например
при тяжелой полицитемии, увеличивает
вязкость крови и снижает MK.
Исследования показали, что для лучшей
доставки кислорода к мозгу гематокрит
должен составлять 30-34 %.
Вегетативная
нервная система
Внутричерепные
сосуды иннервируются симпатическими
(вазоконстрикторными), парасимпатическими
(вазодилатирующими) и нехолинергическими
неадренергическими
волокнами; нейротрансмитте-ры
в последней группе волокон — серотонин
и вазо-активный
интестинальный пептид. Функция
вегетативных
волокон сосудов мозга в физиологических
условиях неизвестна,
но продемонстрировано их участие
при некоторых патологических состояниях.
Так,
импульсация по симпатическим волокнам
pis
верхних
симпатических ганглиев может значительно
сузить крупные мозговые сосуды и
уменьшить MK.
Вегетативная иннервация мозговых
сосудов играет
важную роль в возникновении церебрального
вазоспазма после Ч MT
и инсульта.
Гематоэнцефалический
барьер
Между эндотелиальными
клетками мозговых сосудов практически
отсутствуют поры. Малочисленность
пор — основная морфологическая
особенность
гематоэнцефалического
барьера. Липидный
барьер проницаем для жирорастворимых
веществ, но значительно ограничивает
проникновение ионизированных частиц
и крупных молекул.
Таким
образом, проницаемость гематоэнцефалического
барьера для молекулы какого-либо вещества
зависит от ее размера, заряда, липо-фильности
и степени связывания с белками крови.
Углекислый газ,
кислород и липофильные вещества (к
которым относят большинство анестетиков)
легко проходят через гематоэнцефалический
барьер,
в то время как для большинства ионов,
белков и крупных
молекул (например, маннитола) он
практически
непроницаем.
Вода
свободно проникает через гематоэнцефалический
барьер по механизму объемного тока, а
перемещение
даже небольших ионов затруднено (время
полу выравнивания для натрия составляет
2-4 ч). В результате
быстрые изменения концентрации
электролитов плазмы (а значит, и
осмолярности)
вызывают преходящий
осмотический градиент между плазмой и
мозгом. Остро возникшая гипер-тоничность
плазмы приводит к перемещению воды из
вещества мозга в кровь. При острой
гипотонич-ности плазмы, наоборот,
происходит перемещение воды
из крови в вещество мозга. Чаще всего
равновесие
восстанавливается без особых последствий,
но
в ряде случаев существует опасность
быстро развивающихся
массивных перемещений жидкости, чреватых
повреждением мозга. Следовательно,
значительные
нарушения концентрации натрия или
глюкозы в плазме нужно устранять медленно
(см. гл.
28). Маннитол, осмотически активное
вещество, которое в физиологических
условиях не пересекает гематоэнцефалический
барьер, вызывает устойчивое
уменьшение содержания воды в мозге и
часто используется
для уменьшения объема мозга.
Целостность
гематоэнцефалического барьера нарушают
тяжелая артериальная гипертензия,
опухоли
мозга, ЧМТ, инсульт, инфекции, выраженная
гиперкапния, гипоксия, устойчивая
судорожная активность. При
этих состояниях перемещение
жидкости через гематоэнцефалический
барьер определяется не осмотическим
градиентом, а гидростатическими
силами.
Цереброспинальная
жидкость
Цереброспинальная
жидкость находится
в желудочках
и цистернах головного мозга, а также в
суб-арахноидальном
пространстве ЦНС. Главная функция
цереброспинальной жидкости — защита
мозга
от травмы.
Большая часть цереброспинальной
жидкости вырабатывается в сосудистых
сплетениях желудочков
мозга (преимущественно в боковых).
Некоторое
количество образуется непосредственно
в
клетках эпендимы желудочков, а совсем
небольшая часть — из жидкости,
просачивающейся через периваскулярное
пространство сосудов мозга (утечка
через гематоэнцефалический барьер). У
взрослых образуется 500 мл цереброспинальной
жидкости в сутки
(21 мл/ч), в то время как объем цереброспинальной
жидкости составляет только 150
мл. Из боковых желудочков цереброспинальная
жидкость через межжелудочковые отверстия
(отверстия
Монро) проникает в третий желудочек,
откуда
через водопровод мозга (сильвиев
водопровод)
попадает в четвертый желудочек. Из
четвертого
желудочка через срединную апертуру
(отверстие Мажанди)
и боковые апертуры (отверстия Люшка)
цереброспинальная жидкость поступает
в
мозжечково-мозговую (большую) цистерну
(рис. 25-3), а оттуда — в субарахноидальное
пространство головного и спинного
мозга, где и цир-
кулирует
до тех пор, пока не всасывается в
грануляциях паутинной оболочки
больших полушарий. Для образования
цереброспинальной жидкости необходима
активная секреция натрия в сосудистых
сплетениях.
Цереброспинальная жидкость изото-нична
плазме, несмотря на более низкую
концентрацию
калия, бикарбоната и глюкозы. Белок
поступает в
цереброспинальную жидкость только из
перивас-кулярных
пространств, поэтому его концентрация
очень
невелика. Ингибиторы карбоангидразы
(аце-тазоламид),
кортикостероиды, спиронолактон,
фу-росемид,
изофлюран и вазоконстрикторы уменьшают
выработку цереброспинальной жидкости.

Рис.
25-3. Циркуляция
цереброспинальной жидкости в центральной
нервной системе. (С
разрешения.
Из:
De-GrootJ.,
ChusidJ. G. Correlative
Neuro anatomy, 21st
ed. Appleton
& Lange,
1991.)
Цереброспинальная
жидкость всасывается в грануляциях
паутинной оболочки, откуда попадает в
венозные синусы. Небольшое количество
всасывается
через лимфатические сосуды мозговых
оболочек
и периневральные муфты. Обнаружено, что
всасывание
прямо пропорционально ВЧД и обратно
пропорционально церебральному венозному
давлению; механизм этого явления неясен.
Поскольку
в головном и спинном мозге нет
лимфатических
сосудов, всасывание цереброспинальной
жидкости — основной путь возвращения
белка из
интерстициальных и периваскулярных
пространств
мозга обратно в кровь.
Внутричерепное
давление
Череп
представляет собой жесткий футляр с
нерастягивающимися
стенками. Объем полости черепа неизменен,
его занимает вещество мозга (80 %), кровь
(12
%) и цереброспинальная жидкость (8 %).
Увеличение
объема одного компонента влечет за
собой равное
по величине уменьшение остальных, так
что ВЧД не
повышается. ВЧД
измеряют с помощью датчиков, установленных
в боковом желудочке или на поверхности
полушарий головного мозга; в норме его
величина
не превышает 10 мм рт. ст. Давление
цереброспинальной жидкости, измеренное
при люмбальной пункции
в положении больного лежа на боку,
достаточно
точно соответствует величине ВЧД,
полученной
с помощью внутричерепных датчиков.
Растяжимость
внутричерепной системы определяют,
измеряя прирост ВЧД при увеличении
внутричерепного
объема. Вначале увеличение внутричерепного
объема хорошо компенсируется (рис.
25-4), но
после достижения определенной точки
ВЧД резко
возрастает. Основные компенсаторные
механизмы включают:
(1) смещение цереброспинальной жидкости
из полости черепа в субарахноидальное
пространство
спинного мозга; (2) увеличение всасывания
цереброспинальной жидкости; (3) уменьшение
образования цереброспинальной жидкости;
(4) уменьшение
внутричерепного объема крови (главным
образом за счет венозной).
Податливость
внутричерепной системы неодинакова
в разных участках мозга, на нее влияют
АД и PaCO2.
При повышении АД механизмы ауторе-гуляции
вызывают вазоконстрикцию сосудов мозга
и снижение внутричерепного объема
крови. Артериальная
гипотония, наоборот, приводит к
ва-зодилатации сосудов мозга и увеличению
внутричерепного
объема крови. Таким образом, благодаря
ауторегуляции просвета сосудов MK
не изменяется при колебаниях АД. При
повышении PaCO2
на 1 мм рт. ст. внутричерепной объем крови
увеличивается
на 0,04 мл/100 г.

Рис.
25-4. Растяжимость
внутричерепной системы в норме
Концепцию
растяжимости внутричерепной системы
широко используют в клинической практике.
Растяжимость
измеряют при введении стерильного
физиологического раствора во
внутрижелудоч-ковый
катетер. Если после инъекций 1 мл раствора
ВЧД увеличивается
более чем на 4 мм рт. ст., то растяжимость
считают значительно сниженной. Снижение
растяжимости свидельствует об истощении
механизмов компенсации и служит
прогностическим
фактором уменьшения MK
при дальнейшем прогрессировании
внутричерепной гипертензии.
Устойчивое повышение ВЧД может вызвать
катастрофическую дислокацию и вклинение
различных участков мозга. Выделяют
следующие
виды повреждений (рис. 25-5): (1) ущемление

Рис.
25-5. Дислокации
головного мозга. (С разрешения. Из:
Fishman R. A. Brain edema. New
England
J.
Med.,
1975; 293:706.)
поясной извилины серпом
мозга; (2) ущемление крючка
наметом мозжечка; (3) сдавленна
продолговатого мозга при вклинении
миндалин мозжечка в большое затылочное
отверстие; (4) выпячивание вещества
мозга через дефект черепа.
Влияние
анестетиков
и
вспомогательных средств
наЦНС
Подавляющее большинство
общих анестетиков благоприятно
воздействует на ЦНС, снижая биоэлектрическую
активность мозга. Катаболизм углеводов
уменьшается, в то время как запасы
энергии в виде АТФ, АДФ и фосфокреатина
возрастают. Оценить эффект отдельного
препарата очень сложно, потому что на
него накладывается действие других
средств, хирургическая стимуляция,
растяжимость внутричерепной системы,
АД и PaCO2.
Например, гипокапния и предварительное
введение тиопентала предотвращают
увеличение MK
и ВЧД при использовании кетамина pi
ингаляционных
анестетиков. В этом разделе описано
действие каждого препарата в отдельности.
Итоговая табл. 25-1 позволяет оценить и
сравнить
влияние анестетиков и вспомогательных
средств на ЦНС. В
разделе также обсуждается роль
миорелаксантов и средств, оказывающих
воздействие
на сосудистый тонус.
Ингаляционные
анестетики
Источник

